PUNTOS CLAVE
- Los atletas necesitan prestar atención a estas tres “R” después del ejercicio: Rehidratar, Reponer (glucógeno muscular) y Reparar (proteínas dañadas). La adaptación efectiva al entrenamiento ocurrirá sólo si se presta atención a estas tres “R”.
- Tanto la ingesta de proteínas como el entrenamiento de fuerza estimulan el proceso de síntesis de nuevas proteínas musculares (SPM) y actúan de forma sinérgica cuando las proteínas se ingieren después del ejercicio. En personas saludables, los cambios en la SPM tienen una influencia mucho mayor sobre la ganancia neta de músculo que los cambios en la degradación de proteínas musculares (DPM).
- La sumatoria de períodos con balances positivos de proteínas musculares (es decir, cuando la SPM supera al DPM) produce hipertrofia muscular. La evidencia actual favorece el consumo de proteínas después del ejercicio ya que produce una mayor tasa de SPM y una mayor hipertrofia.
- No se conoce el período de tiempo exacto durante el cual es beneficioso consumir proteínas después del ejercicio. Sin embargo, el efecto anabólico del ejercicio es de larga duración, pero probablemente disminuye con el paso del tiempo después del ejercicio.
- Para el mantenimiento y construcción de la masa muscular es necesaria una mayor ingesta diaria de proteínas en el rango de 1,4-1,6 g/kg/día (superior a la RDA, que actualmente es de 0,8 g de proteína/kg de peso corporal/día).
- Los atletas deben consumir proteínas en todas las comidas para promover una síntesis de proteína óptima después de cada ingesta (0.25-0.30 g proteína/kg peso corporal/comida). Además, las proteínas de alta calidad provenientes de la leche, como la caseína y la proteína de suero de leche, pueden evitar la pérdida de tejido magro y promover su aumento durante períodos de entrenamiento intenso o restricción calórica.
- Las proteínas de digestión rápida que contienen altas proporciones de aminoácidos esenciales (AAE), de los cuales el aminoácido clave parece ser la leucina, son más efectivas para estimular la SPM que otras proteínas.
- No hay evidencias que respalden la necesidad de suplementos de proteínas para alcanzar los objetivos señalados aquí. Las proteínas de los alimentos, particularmente las lácteas de alta calidad, que contienen todos los AAE y son altos en leucina pueden ser más efectivas que otras fuentes de proteínas.
INTRODUCCIÓN
Los procesos de síntesis de proteínas musculares (SPM) y desdoblamiento de proteínas musculares (DPM) ocurren simultáneamente. Este recambio constante de proteínas permite a las fibras musculares modificar su estructura cuando varían las exigencias de las cargas o la alimentación. La plasticidad del músculo esquelético de responder al cambio de las cargas o los patrones de contracción es una evidencia de la capacidad de remodelarse presente en las fibras. Por ejemplo, está bien documentado que la cantidad de mitocondrias aumenta con el entrenamiento de resistencia o aeróbico. Por el contrario, cargas más pesadas producen menos cambios en el contenido mitocondrial, pero se incrementan las proteínas contráctiles o miofibrillas. Todas las adaptaciones ambientales mencionadas anteriormente representan un rediseño de los patrones de expresión genética del músculo, la traslación de proteínas y el proceso de degradación de las estructuras de proteína existentes para “insertar” las nuevas proteínas. Un recambio constante de proteínas musculares también proporciona un mecanismo sostenido para su “mantenimiento” a través de la remoción de proteínas dañadas y su cambio por nuevas proteínas. El deterioro de las proteínas puede producirse por su oxidación o simplemente a través de un daño mecánico debido a fuerzas elevadas durante contracciones excéntricas. Independientemente del mecanismo, el balance entre el proceso de síntesis (SPM) y degradación de proteínas (DPM) determinará la ganancia neta, la pérdida o el mantenimiento de las proteínas en la miofibrilla. En líneas generales, el balance de proteínas determina si la fibra muscular aumenta (hipertrofia) o se reduce (atrofia). Evidencias recientes destacan la regulación del proceso de síntesis de proteínas (Philp et al., 2011), y su degradación (Glass, 2010), por lo que se refiere al lector a esas publicaciones para información más precisa sobre la regulación de la SPM y el DPM, respectivamente.
Lo que conocemos bien es que en los humanos, realizar ejercicio de fuerza solo (Phillips et al., 1997) y el consumo de proteínas o aminoácidos solo (Bohe et al., 2001), son potentes estimulantes de la SPM y principalmente de las proteínas de las miofibrillas (Moore et al., 2009b). Una combinación de ejercicio de fuerza y consumo de proteínas, usualmente en forma de aminoácidos o proteínas consumidas después del ejercicio, produjeron una estimulación sinérgica de la SPM (Biolo et al., 1997). Se piensa que la estimulación de la SPM es un proceso clave en el incremento del tamaño del músculo inducido por el ejercicio y que este proceso eventualmente es sumatorio para producir hipertrofia (Breen & Phillips, 2012; Churchward-Venne et al., 2012). Se han encontrado concordancias entre los cambios a corto plazo en la SPM o el balance neto de proteínas (es decir, SPM menos DPM) y las ganancias de masa muscular a largo plazo cuando se suministran nutrientes (Hartman et al., 2007; Wilkinson et al., 2007) y diferentes estímulos contráctiles (Mitchell et al., 2012). Además, parece que al menos en humanos saludables, independientemente de su edad, las fluctuaciones de SPM entre una comida y otra son mucho más influyentes en determinar las ganancias (Breen & Phillips, 2012; Churchward-Venne et al., 2012) y pérdidas (Phillips et al., 2009) de masa muscular esquelética. Así, desde un punto de vista dinámico, las ondulaciones en la SPM y sólo pequeños cambios en el DPM determinan el balance neto de proteínas (Figura 1).

AMINOÁCIDOS: PROPIEDADES Y DOSIS EN LA ESTIMULACIÓN DE LA SPM
El consumo de proteínas o aminoácidos estimula la SPM, y el efecto parece ser casi exclusivamente debido a los aminoácidos per se y no a cambios en hormonas como la insulina (Biolo et al., 1997; Fujita et al.,2007). Parece que sólo los aminoácidos esenciales (AAE) son necesarios para este efecto (Volpi et al., 2003). En particular el aminoácido leucina ocupa un lugar prominente ya que él solo actúa como una señal que estimula la SPM (Philp et al., 2011). Sin embargo, se debe destacar que la leucina no puede producir un aumento de la SPM en ausencia de un complemento que incluya todos los AAE (Churchward-Venne et al., 2012). Así, una mezcla completa de aminoácidos (Tipton et al., 1999) o la ingesta de proteínas intactas (Tipton et al., 2004; Wilkinson et al., 2007) son necesarias para producir un incremento en la SPM.
Es interesante saber que, desde la perspectiva de dosificación de las proteínas, el proceso de SPM es saturable. Esto tiene sentido, ya que existe una capacidad finita de acumular aminoácidos en el músculo y no hay un “reservorio” extra para ajustar el exceso de nitrógeno proteico más allá del que puede usarse para los procesos que requieren aminoácidos. La dosis-respuesta de la SPM parece estar en función de la concentración de aminoácidos extracelulares y no de los intracelulares (Bohe et al., 2003). Se encontró que la respuesta de la SPM tanto en jóvenes como en personas mayores, se estabiliza en ~10 g de aminoácidos esenciales (Cuthbertson et al., 2005). Nosotros también reportamos esta dosis-respuesta de SPM después del ejercicio empleando proteína aislada de huevos como alimento (Moore et al., 2009a). Lo que observamos, similar a lo que fue reportado previamente (Cuthbertson et al., 2005), fue que la estabilización en la SPM ocurrió al ingerir 20 g de proteína (~8,5 g de aminoácidos esenciales). La Figura 2 muestra un gráfico estilizado de la respuesta de la SPM, así como el trazo correspondiente a la oxidación de leucina como un índice de catabolismo de aminoácidos. Lo que es evidente es que la SPM se estabiliza y que los aminoácidos “extra” simplemente se usan como combustible. La Figura 2 también demuestra que el consumo de cantidades muy grandes de aminoácidos y proteínas creyendo que acelerarán las ganancias de masa muscular inducidas por el ejercicio no es correcta. Por el contario, la ingesta de “tan sólo” 20 g de proteína de alta calidad (0,25 g de proteína/Kg masa corporal/comida) puede llevar al máximo el estímulo de la SPM, el proceso que dirige los cambios en la masa muscular. Por supuesto, los atletas más grandes (que los sujetos de 87 Kg estudiados por Moore et al., 2009a) pueden requerir más proteína para llevar al máximo la SPM y los atletas más pequeños menos.
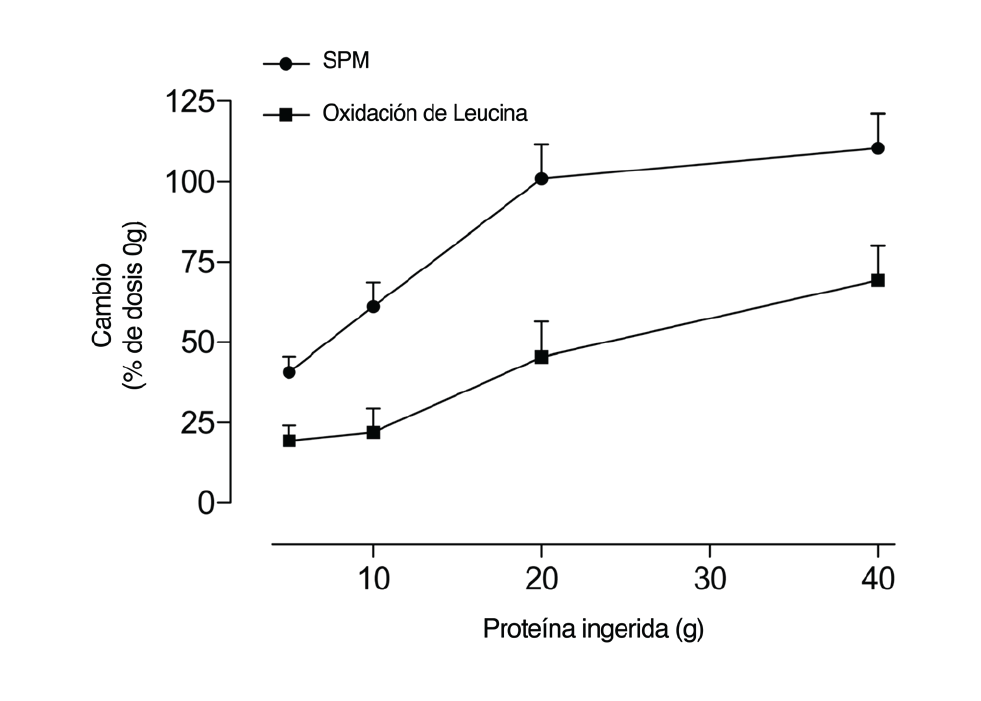
Figura 2: Porcentaje de incremento (desde un estado basal ó 0 g) en la síntesis de proteínas musculares (SPM) y la oxidación de leucina después del ejercicio de fuerza en hombres jóvenes como respuesta a la ingesta de proteínas y la dosis de leucina. La proteína ingerida fue proteína aislada de huevo, los datos son tomados de Moore et al., 2009a.
NUTRICIÓN Y EJERCICIO: INTERACCIONES CRUCIALES
Los efectos del ejercicio de fuerza solo, son potentes y de larga duración, elevando el estado basal de SPM durante al menos 48 h (Phillips et al., 1997). Se ha demostrado en numerosas ocasiones que el consumo de proteína inmediatamente después del ejercicio estimula la SPM aún más (Breen & Phillips, 2012; Churchward-Venne et al., 2012). Inclusive hasta 24 h después del ejercicio de fuerza el músculo permanece sensible a los efectos del ejercicio y demuestra un incremento en la respuesta de la SPM al aumentarse los niveles sanguíneos de aminoácidos (Burd et al., 2011). Así, es razonable proponer que inclusive en momentos posteriores a las 24 h, pareciera haber un aumento en la sensibilidad (Figura 3).
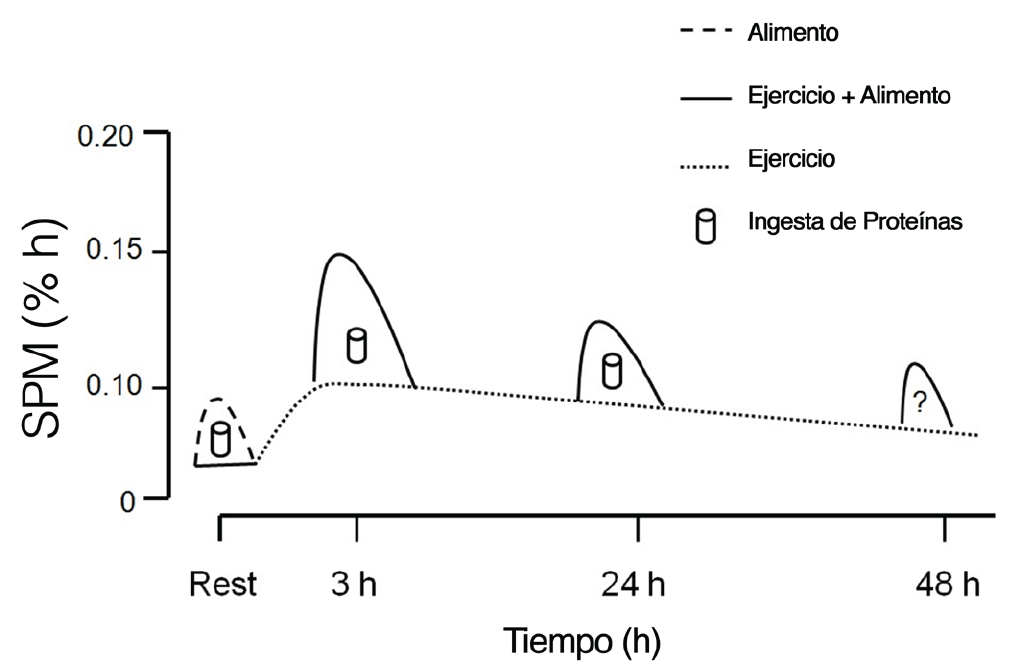
Figura 3: El ejercicio de fuerza estimula un incremento prolongado en la síntesis de proteínas musculares (SPM) que puede permanecer elevada durante ≥ 24 h (líneas punteadas). Así nosotros proponemos que la ingesta de proteínas en cualquier momento durante este período de “potencial anabólico” aumentado será aditivo para estas tasas ya elevadas producidas por el ejercicio (líneas sólidas).
Como ilustra la Figura 3 “la ventana” para el consumo de proteínas es más larga de lo que apreciábamos anteriormente. No obstante, es posible que existan ventajas al consumir proteínas en momentos cercanos al ejercicio.
MOMENTO DE INGESTA DE PROTEÍNAS
Existen bases fisiológicas de por qué el consumo agudo de proteínas cercano a la realización de ejercicio de fuerza puede tener un efecto estimulante sobre la síntesis de proteínas musculares y la construcción de tejido magro (Hartman et al., 2007; Holm et al., 2006). El aumento en la concentración de aminoácidos en sangre en conjunto con la ejecución de ejercicio de fuerza podría “sacar provecho” de los mecanismos que están activados a nivel celular después del ejercicio (Philp et al., 2011). Existen evidencias que respaldan la importancia del consumo de proteínas (o aminoácidos) y no simplemente de energía en forma de carbohidratos, en momentos cercanos a la realización de ejercicio de fuerza para producir una mayor hipertrofia (Hartman et al., 2007; Holm et al., 2006). Estos estudios de entrenamiento a largo plazo sugieren que la “ventana” durante la cual deben consumirse las proteínas o aminoácidos es probablemente <2 h después del ejercicio, para favorecer mayores incrementos en la masa corporal magra y la hipertrofia muscular en individuos jóvenes. Es necesario resaltar que en un estudio a corto plazo se encontraron respuestas completamente anabólicas en el músculo esquelético de sujetos jóvenes tanto 1 h como 3 h después del ejercicio posterior al consumo de aminoácidos cristalinos (Rasmussen et al., 2000). Sin embargo, no se ha investigado si este patrón de alimentación se traduciría en una hipertrofia similar con el entrenamiento. Por lo tanto, con la intención de favorecer una mayor hipertrofia debido al entrenamiento de fuerza, a cualquier edad, sería beneficioso consumir una fuente de proteína dentro de la primera hora después de finalizado el ejercicio. En estudios con entrenamientos a largo plazo, los efectos del suministro inmediato de nutrientes (o al menos temporalmente cerca) parece aumentar las ganancias en la masa muscular (Hartman et al., 2007; Holm et al., 2006). El impacto de la alimentación pre ejercicio recibió una atención particular por los hallazgos de Tipton y colaboradores (2001), quienes mostraron que el consumo de aminoácidos antes, versus después del ejercicio, producían un aumento en el balance neto de aminoácidos posterior al ejercicio. Sin embargo, es importante destacar que dos estudios posteriores (Fujita et al., 2009; Tipton et al., 2006) no pudieron reproducir los hallazgos del efecto estimulante de la alimentación pre ejercicio (Tipton et al., 2001). Así, en este momento no está claro si la nutrición pre ejercicio puede efectivamente aumentar el anabolismo después del ejercicio.
FUENTE DE PROTEÍNAS: IMPACTO EN LA SPM
Todos los estudios a corto plazo en los cuales los sujetos han consumido proteínas de leche entera (completa) o proteínas de soya (Elliot et al., 2006; Wilkinson et al., 2007), tanto aisladas como en suplementos (Tipton et al., 2004; Tipton et al., 2006), han demostrado que estas proteínas son capaces de favorecer la acumulación de proteínas musculares después del ejercicio de fuerza. Por ejemplo, se comparó la habilidad de la leche descremada (237 mL, 377 kJ, 8,8 g proteínas), la leche entera (completa) (237 mL, 627 kJ, 8,0 g proteínas) y una cantidad similar en calorías (a la leche entera) de leche descremada (393 mL, 626 kJ, 14,5 g proteínas) para promover la construcción de músculos después del ejercicio (Elliot et al., 2006). Se encontró que la leche entera o completa produjo una mayor captación de treonina y una mayor tendencia a la captación de fenilalanina en la pierna ejercitada, sugiriendo que la leche entera o completa fue superior a la leche descremada en su habilidad para construir músculo después del ejercicio. Las consecuencias a largo plazo del consumo de cantidades equivalentes en nitrógeno de leche descremada versus leche entera sugieren que debe producir una mayor acumulación de proteínas, pero carecemos de estudios a largo plazo para hacer tal conclusión ahora. Cuando se comparó el consumo de leche descremada (500 mL, 745 kJ, 18,2 g proteínas) versus una bebida de proteína de soya con una composición similar de calorías, nitrógeno y macronutrientes, se reportó un balance neto de proteínas y una tasa de síntesis fraccional superior con la ingesta de leche (Wilkinson et al., 2007). Se planteó como hipótesis que estos hallazgos eran producto de las diferencias en las tasas de digestión de las proteínas, las cuales afectaban el aumento de aminoácidos en la sangre y en consecuencia impactaban el anabolismo muscular. Esto está respaldado por los datos de los estudios que documentan las diferencias en cómo la leche y la proteína de soya son fraccionadas para utilizarse entre los tejidos esplénicos y periféricos (músculo) (Fouillet et al., 2002). Específicamente, las proteínas de soya mantienen una mayor síntesis de proteínas viscerales y son convertidas a urea en una mayor proporción que las proteínas de leche (Fouillet et al., 2002). Un hidrolizado de proteína de suero de leche de digestión rápida fue más efectivo que la soya y la caseína micelar (la forma de caseína en la leche) en estimular la SPM tanto en reposo como después del ejercicio de fuerza, así como la respuesta de la SPM en relación al pico de concentración de leucina (Tang et al., 2009). Tal observación se confirmó recientemente (Pennings et al., 2011) con resultados virtualmente idénticos al consumir proteína de suero de leche y caseína. Estos datos (Pennings et al., 2011; Tang et al., 2009) conducen a proponer la hipótesis del “disparo de leucina” (Figura 4), la cual simplemente señala que se puede predecir que la proteína de más rápida digestión que contenga una alta proporción de leucina puede ser más efectiva en promover un incremento de la SPM (Breen & Phillips, 2012; Churchward-Venne et al., 2012).
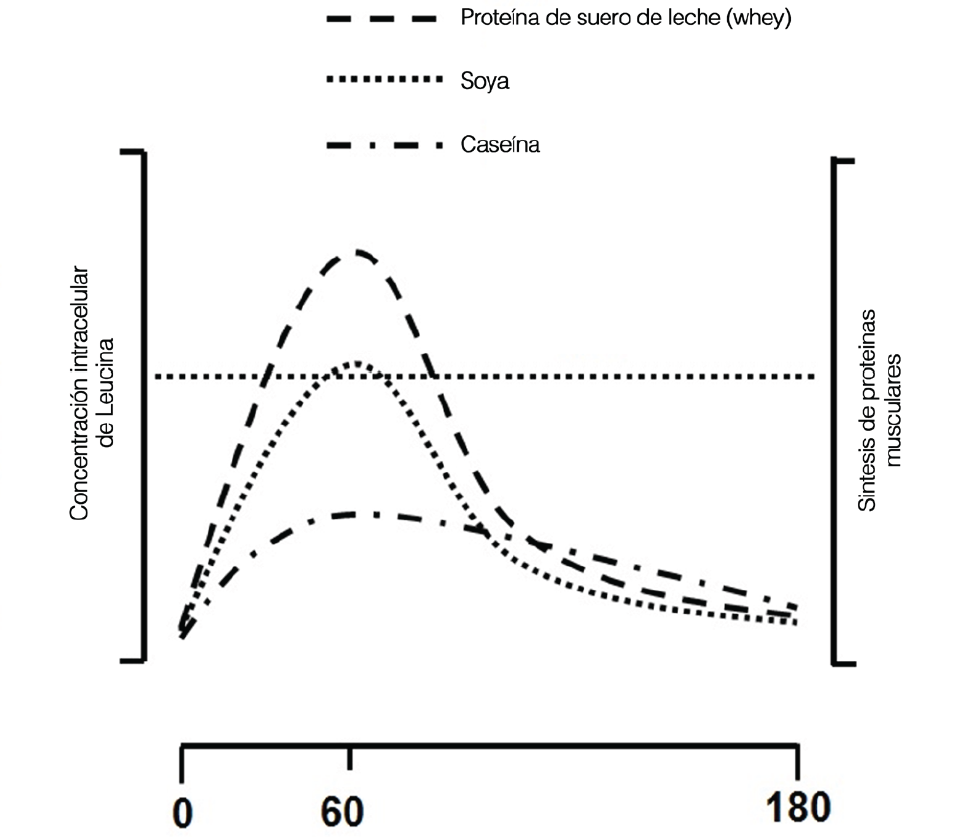
Figura 4. El concepto del “disparo de leucina” con datos adaptados de (Tang et al., 2009) se muestran para proteína de suero de leche, proteína de soya y caseína. Estas proteínas pueden ser digeridas en el siguiente orden proteína de suero de leche ≥ soya >> caseína y el siguiente contenido de leucina: proteína de suero de leche > caseína > soya. Así, a un mayor y más rápido aumento sanguíneo de “disparadores de leucina” habrá incremento superior en la SPM.
Además de la hidratación y los carbohidratos, debe reconocerse la importancia de las proteínas por su papel en permitir la adaptación y la recuperación. La ingesta excesiva de proteínas no parece ayudar en la promoción de la adaptación y puede comprometer la ingesta de otros nutrientes importantes como los carbohidratos. Con los niveles recomendados aquí y con particular atención al consumo de proteínas en el período posterior al ejercicio, los atletas deben ser capaces de llevar al máximo su recuperación muscular y probablemente la de los tejidos conectivos y en consecuencia permitiendo que el rendimiento alcance su máximo potencial.
APLICACIONES PRÁCTICAS
- Consuma proteínas después del ejercicio para llevar al máximo la síntesis de proteína y promover la adaptación.
- Las formas líquidas de proteína son las mejores debido a su rápida tasa de digestión.
- Las proteínas de digestión rápida son mejores, siendo las proteínas aisladas tales como la proteína de suero de leche, proteínas de leche o soya las que parecen ser más eficientes.
- Debido a su contenido de leucina, la proteína de suero de leche representa, gramo a gramo, la mejor fuente de proteína para estimular la síntesis de nuevas proteínas musculares.
- Consuma proteínas durante el día a intervalos regulares para llevar al máximo la respuesta anabólica (20 a 25 g por comida o entre 0,25 a 0,30 g de proteína/ Kg de masa corporal/ comida).
- Las cantidades excesivas de proteínas no son necesarias para un buen rendimiento. Sin embargo, los niveles de ingesta de proteínas entre 1,2 a 1,6 g proteína/kg de masa corporal/día pueden ser adecuados y más de lo requerido por la mayoría de los atletas, incluso durante entrenamientos fuertes.
REFERENCIAS
Biolo, G., K. D. Tipton, S. Klein, and R. R. Wolfe (1997). An abundant supply of amino acids enhances the metabolic effect of exercise on muscle protein. Am. J. Physiol. 273: E122-E129.
Bohe, J., J. F. Low, R. R. Wolfe, and M. J. Rennie (2001). Latency and duration of stimulation of human muscle protein synthesis during continuous infusion of amino acids. J. Physiol. 532: 575-579.
Bohe, J., A. Low, R. R. Wolfe, and M. J. Rennie (2003). Human muscle protein synthesis is modulated by extracellular, not intramuscular amino acid availability: a dose-response study. J. Physiol. 552: 315-324.
Breen, L., and S. M. Phillips (2012). Nutrient interaction for optimal protein anabolism in resistance exercise. Curr. Opin. Clin. Nutr. Metab. Care 15: 226-232.
Burd, N.A., D. W. West, D. R. Moore, P. J. Atherton, A. W. Staples, T. Prior, J. E. Tang, M. J. Rennie, S. K. Baker, and S. M. Phillips (2011). Enhanced amino acid sensitivity of myofibrillar protein synthesis persists for up to 24 h after resistance exercise in young men. J. Nutr. 141: 568-573.
Churchward-Venne, T.A., N. A. Burd, and S. M. Phillips (2012). Nutritional regulation of muscle protein synthesis with resistance exercise: strategies to enhance anabolism. Nutr. Metab. (Lond.) 9: 40.
Cuthbertson, D., K. Smith, J. Babraj, G. Leese, T. Waddell, P. Atherton, H. Wackerhage, P. M. Taylor, and M. J. Rennie (2005). Anabolic signaling deficits underlie amino acid resistance of wasting, aging muscle. FASEB J. 19: 422-424.
Elliot, T.A., M. G. Cree, A. P. Sanford, R. R. Wolfe, and K. D. Tipton (2006). Milk ingestion stimulates net muscle protein synthesis following resistance exercise. Med. Sci. Sports Exerc. 38: 667-674.
Fouillet, H., F. Mariotti, C. Gaudichon, C. Bos, and D. Tome (2002). Peripheral and splanchnic metabolism of dietary nitrogen are differently affected by the protein source in humans as assessed by compartmental modeling. J. Nutr. 132: 125-133.
Fujita, S., H. C. Dreyer, M. J. Drummond, E. L. Glynn, J. G. Cadenas, F. Yoshizawa, E. Volpi, and B. B. Rasmussen (2007). Nutrient signalling in the regulation of human muscle protein synthesis. J. Physiol. 582: 813-823.
Fujita, S., H. C. Dreyer, M. J. Drummond, E. L. Glynn, E. Volpi, and B. B. Rasmussen (2009). Essential amino acid and carbohydrate ingestion before resistance exercise does not enhance postexercise muscle protein synthesis. J. Appl. Physiol. 106: 1730-1739.
Glass, D.J. (2010). Signaling pathways perturbing muscle mass. Curr. Opin. Clin. Nutr. Metab. Care 13: 225-229.
Hartman, J.W., J. E. Tang, S. B. Wilkinson, M. A. Tarnopolsky, R. L. Lawrence, A. V. Fullerton, and S. M. Phillips (2007). Consumption of fat-free fluid milk after resistance exercise promotes greater lean mass accretion than does consumption of soy or carbohydrate in young, novice, male weightlifters. Am. J. Clin. Nutr. 86: 373-381.
Holm, L., B. Esmarck, M. Mizuno, H. Hansen, C. Suetta, P. Holmich, M. Krogsgaard, and M. Kjaer (2006). The effect of protein and carbohydrate supplementation on strength training outcome of rehabilitation in ACL patients. J. Orthop. Res. 24:2114-2123.
Karlsson, H.K., P. A. Nilsson, J. Nilsson, A. V. Chibalin, J. R. Zierath, and E. Blomstrand (2004). Branched-chain amino acids increase p70S6k phosphorylation in human skeletal muscle after resistance exercise. Am. J. Physiol. 287: E1-E7.
Mitchell, C.J., T. A. Churchward-Venne, D. D. West, N. A. Burd, L. Breen, S. K. Baker, and S. M. Phillips (2012). Resistance exercise load does not determine training-mediated hypertrophic gains in young men. J Appl. Physiol. 113:71-77.
Moore D.R., M. J. Robinson, J. L. Fry, J. E. Tang, E. I. Glover, S. B. Wilkinson, T. Prior, M. A. Tarnopolsky, and S. M. Phillips (2009a). Ingested protein dose response of muscle and albumin protein synthesis after resistance exercise in young men. Am. J. Clin. Nutr. 89: 161-168.
Moore, D.R., J. E. Tang, N. A. Burd, T. Rerecich, M. A. Tarnopolsky, and S. M. Phillips (2009b). Differential stimulation of myofibrillar and sarcoplasmic protein synthesis with protein ingestion at rest and after resistance exercise. J. Physiol. 597: 897-904.
Pennings, B., Y. Boirie, J. M. Senden, A. P. Gijsen, H. Kuipers, and L. J. van Loon (2011). Whey protein stimulates postprandial muscle protein accretion more effectively than do casein and casein hydrolysate in older men. Am. J. Clin. Nutr. 93: 997-1005.
Phillips, S.M., K. D. Tipton, A. Aarsland, S. E. Wolf, and R. R. Wolfe (1997). Mixed muscle protein synthesis and breakdown after resistance exercise in humans. Am. J. Physiol. 273: E99-E107.
Phillips, S.M., E. I. Glover, and M. J. Rennie (2009). Alterations of protein turnover underlying disuse atrophy in human skeletal muscle. J. Appl. Physiol. 107: 643-654.
Philp A., D. L. Hamilton, and K. Baar (2011). Signals mediating skeletal muscle remodeling by resistance exercise: PI3-kinase independent activation of mTORC1. J. Appl. Physiol. 110: 561-568.
Rasmussen, B.B., K. D. Tipton, S. L. Miller, S. E. Wolf, and R. R. Wolfe (2000). An oral essential amino acid-carbohydrate supplement enhances muscle protein anabolism after resistance exercise. J. Appl. Physiol. 88: 386-392.
Tang, J.E., D. R. Moore, G. W. Kujbida, M. A. Tarnopolsky, and S. M. Phillips (2009). Ingestion of whey hydrolysate, casein, or soy protein isolate: effects on mixed muscle protein synthesis at rest and following resistance exercise in young men. J. Appl. Physiol. 107: 987-992.
Tipton, K.D., A. A. Ferrando, S. M. Phillips, D. Doyle, Jr., and R. R. Wolfe (1999). Postexercise net protein synthesis in human muscle from orally administered amino acids. Am. J. Physiol. 276: E628-E634.
Tipton, K.D., B. B. Rasmussen, S. L. Miller, S. E. Wolf, S. K. Owens-Stovall, B. E. Petrini, and R. R. Wolfe (2001). Timing of amino acid-carbohydrate ingestion alters anabolic response of muscle to resistance exercise. Am. J. Physiol. 281: E197-E206. Tipton, K.D., T. A. Elliott, M. G. Cree, S. E. Wolf, A. P. Sanford, and R. R. Wolfe (2004). Ingestion of casein and whey proteins result in muscle anabolism after resistance exercise. Med. Sci. Sports Exerc. 36: 2073-2081.
Tipton, K.D., T. A. Elliott, M. G. Cree, A. A. Aarsland, A. P. Sanford, and R. R. Wolfe (2006). Stimulation of Net Muscle Protein Synthesis by Whey Protein Ingestion Before and After Exercise. Am. J. Physiol. 292: E71-E76.
Volpi, E., H. Kobayashi, M. Sheffield-Moore, B. Mittendorfer, and R. R. Wolfe (2003). Essential amino acids are primarily responsible for the amino acid stimulation of muscle protein anabolism in healthy elderly adults. Am. J. Clin. Nutr. 78: 250-258.
Wilkinson, S.B., M. A. Tarnopolsky, M. J. MacDonald, J. R. Macdonald, D. Armstrong, and S. M. Phillips (2007). Consumption of fluid skim milk promotes greater muscle protein accretion following resistance exercise than an isonitrogenous and isoenergetic soy protein beverage. Am. J. Clin. Nutr. 85: 1031-1040.
TRADUCCIÓN
Este articulo ha sido traducido de: Phillips, S.M. Protein consumption and resistance exercise: Maximizing anabolic potential. Sports Science Exchange (2013) Vol. 26, No.107, 1-5, por el M.Sc. Pedro Reinaldo García.