Stuart M. Phillips, PhD
POINTS IMPORTANTS
- Après un exercice, les athlètes doivent faire particulièrement attention à la règle des trois « R » : réhydratation, rétablissement (glycogène musculaire) et réparation (protéines endommagées). Pour être efficace, l'adaptation à l’entraînement doit respecter la règle des trois R.
- Un apport en protéines et l’exercice contre résistance stimulent tous deux la synthèse des nouvelles protéines musculaires et agissent de façon synergique si l'exercice est suivi de la consommation de protéines. Chez les personnes en santé, les changements de la synthèse des protéines musculaires (SPM) ont une influence bien plus grande sur le gain net de masse musculaire que les changements dans la dégradation des protéines musculaires (DPM).
- L'accumulation de périodes avec un bilan positif des protéines musculaires, ou quand la SPM est supérieure à la DPM, entraîne une hypertrophie des muscles. Avec un apport en protéines assez proche du moment de l’exercice, et selon les recommandations actuelles vaut mieux après l’exercice, le taux de synthèse des protéines et l'hypertrophie musculaires augmentent.
- Le moment exact où, après l’exercice, la consommation de protéines a des effets bénéfiques n'est pas encore connu; toutefois, l’effet anabolique de l’exercice dure longtemps après même s’il diminue probablement en fonction du temps.
- Pour maintenir et renforcer la masse musculaire, il faut un plus grand apport quotidien en protéines que l’apport nutritionnel recommandé, actuellement fixé à 0,8 g de protéines/kg de masse corporelle par jour, et il devrait être de 1,4 à 1,6 g/kg/jour.
- Pour favoriser la synthèse postprandiale optimale des protéines (0,25 à 0,30 g de protéines/kg de masse corporelle/repas), les athlètes devraient consommer des protéines à chaque repas. De plus, les protéines de grande qualité, soit les protéines à base de lait comme la caséine et le lactosérum, peuvent éviter les pertes de masse maigre et en augmenter les gains lors des périodes d’entraînement intense ou de restriction calorique.
- Les protéines rapidement digérées qui contiennent de fortes proportions d’acides aminés essentiels, dont le plus important semble être la leucine, stimulent plus efficacement la synthèse des protéines musculaires que les autres protéines.
- Il n’existe pas de données justifiant la recommandation selon laquelle il est nécessaire de prendre des suppléments de protéines pour atteindre les objectifs dont il est question ici. Les protéines alimentaires, surtout les protéines de grande qualité, contiennent tous les acides aminés essentiels, et celles qui ont une forte teneur en leucine peuvent s’avérer plus efficaces que les autres sources de protéines.
INTRODUCTION
La synthèse des protéines musculaires (SPM) et la dégradation des protéines musculaires (DPM) se produisent simultanément. Ce renouvellement constant de protéines permet aux fibres musculaires de modifier leur structure protéique en fonction des charges ou des changements alimentaires. La plasticité du muscle squelettique qui réagit aux modifications de tension et aux profils contractiles est une preuve de la capacité de remodelage des fibres. Il est très bien établi, par exemple, que le contenu des mitochondries augmente au cours d’une épreuve d’endurance. En revanche, une plus forte charge produit moins de changement du contenu mitochondrial, mais elle augmente les protéines contractiles ou myofibrillaires. Toutes les adaptations au milieu environnant susmentionnées représentent une restructuration du modèle d’expression des gènes musculaires, de la traduction des protéines et des processus servant au catabolisme des structures protéiques actuelles en vue d’« introduire » de nouvelles protéines. Le renouvellement continu des protéines musculaires constitue un mécanisme de « maintien » constant des protéines en retirant les protéines endommagées et en les remplaçant par de nouvelles. Les protéines subissent des dommages par oxydation ou simplement des bris mécaniques en raison des forces élevées exercées lors des contractions d’étirement. Peu importe le mécanisme, c’est l'équilibre entre synthèse et dégradation des protéines musculaires qui détermine s’il y a gain net, perte nette ou aucun changement dans les protéines des myofibres. Sur le plan macroscopique, le bilan en protéines détermine si la taille des fibres musculaires augmente (hypertrophie) ou si elle diminue (atrophie). De récentes analyses mettent en lumière la régulation de la synthèse de protéines (Philp et coll., 2011) et leur dégradation (Glass, 2010), si bien que nous renvoyons le lecteur à ces publications pour des renseignements plus précis sur la régulation de ces deux processus.
Il est bien connu que, chez l’humain, la seule pratique d’un exercice contre résistance (Phillips et coll., 1997) ou la seule consommation de protéines ou d’acides aminés (Bohe et coll., 2001) sont toutes deux de puissants stimulateurs des protéines myofibrillaires (Moore et coll., 2009b). L’effet combiné de l’exercice contre résistance et de la consommation de protéines, le plus souvent sous forme d’acides aminés ou de protéines ingérés après l’exercice, produit une stimulation synergique de la synthèse des protéines musculaires (Biolo et coll., 1997). Fondamentalement, il est reconnu que la stimulation de la synthèse des protéines musculaires est l’un des principaux processus générant une augmentation du volume musculaire induite par l’exercice, ce qui se traduit éventuellement par une hypertrophie (Breen et Phillips, 2012; Churchward-Venne et coll., 2012). Plusieurs études en viennent aux mêmes conclusions en ce qui concerne les changements à court terme dans la synthèse des protéines musculaires (SPM), ou le bilan net de protéines musculaires (ou SPM moins DPM) et les gains à long terme de masse musculaire avec un apport en nutriments (Hartman et coll., 2007; Wilkinson et coll., 2007) et différents modèles de contraction (Mitchell et coll., 2012). Il semble de plus que, du moins chez les humains en bonne santé et sans égard à l'âge, les variations dans la synthèse des protéines musculaires d’un repas à l’autre jouent un rôle bien plus déterminant dans les gains (Breen et Phillips, 2012; Churchward-Venne et coll., 2012) ou les pertes (Phillips et coll., 2009) de masse musculaire. Alors, dans une perspective dynamique, ce sont les fluctuations de la synthèse des protéines musculaires et seulement de légers changements dans la dégradation des protéines musculaires qui déterminent le bilan protéique net (Figure 1).
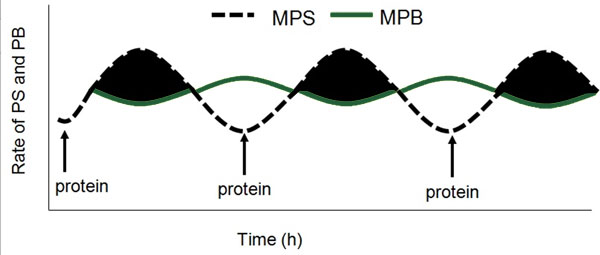
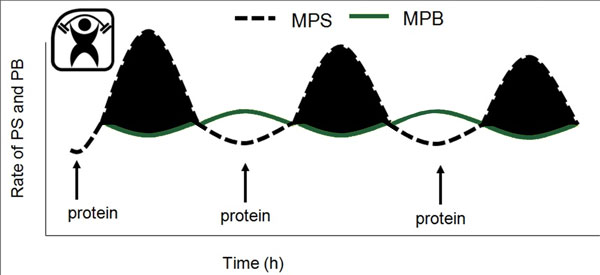
ACIDES AMINÉS : PROPRIÉTÉS ET DOSES DANS LA STIMULATION DE LA SPM
Un apport en protéines ou en acides aminés stimule la synthèse des protéines musculaires, un effet qui semble dû exclusivement à la présence des acides aminés eux-mêmes et non à des modifications de la concentration d’hormones comme l’insuline (Biolo et coll., 1997; Fujita et coll., 2007). Il semble que seuls les acides aminés essentiels sont nécessaires pour produire cet effet (Volpi et coll., 2003). Plus précisément, l’acide aminé leucine occupe une place de choix puisque lui seul agit comme signal de stimulation de la synthèse des protéines musculaires (Philp et coll., 2011). Il faut noter toutefois que la leucine ne peut pas stimuler la synthèse des protéines musculaires sans un supplément complet d'acides aminés essentiels (Churchward-Venne et coll., 2012). Par conséquent, il faut un assortiment complet d’acides aminés (Tipton et coll., 1999) ou l’ingestion de protéines intactes (Tipton et coll., 2004; Wilkinson et coll., 2007) pour favoriser la synthèse des protéines musculaires.
Fait à noter, la dose de protéines peut saturer la synthèse des protéines musculaires, ce qui serait logique puisque la capacité de stocker les acides aminés dans les muscles est limitée et qu’il n’y a pas d’autre « réservoir » de protéines pour recevoir l’excédent d’azote protéique au-delà de ce qui utilisé dans les processus qui nécessitent la présence d’un acide aminé. La relation dose-effet de la synthèse des protéines musculaires semble dépendre de la concentration d’acides aminés extracellulaires plutôt qu’intracellulaires (Bohe et coll., 2003). La réaction à la synthèse des protéines musculaires plafonne à environ 10 g d’acides aminés indispensables ou essentiels, tant chez les jeunes gens que chez les personnes âgées (Cuthbertson et coll., 2005). Nous avons également établi les résultats de la relation dose-effet en ce qui concerne la synthèse des protéines musculaires après un exercice contre résistance en prenant un isolat de protéines d’œuf comme source alimentaire (Moore et coll., 2009a). Les résultats observés sont similaires à ceux qui existaient déjà (Cuthbertson et coll., 2005), à savoir qu’un plafonnement de la synthèse des protéines musculaires se produit après ingestion de 20 g de protéines (environ 8,5 g d’acides aminés essentiels). La Figure 2 montre une courbe simplifiée de la réaction à la synthèse des protéines musculaires ainsi qu’une courbe correspondante pour l’oxydation de la leucine servant d’indice du catabolisme des acides aminés. Cette étude a révélé qu’à mesure que la synthèse des protéines musculaires plafonne, les acides aminés « en surplus » sont simplement utilisés comme carburant. La Figure 2 montre également qu’il est faux de croire que consommer de très grandes quantités d’acides aminés ou de protéines accélère les gains de masse musculaire induits par l’entraînement. En revanche, l’ingestion d’une « simple » quantité de 20 g de protéines de grande qualité (0,25 g de protéines/kg de masse corporelle/repas) stimule au maximum la synthèse des protéines musculaires sur laquelle reposent les changements de masse musculaire. Bien sûr, les athlètes dont le poids est plus élevé (qui pèsent plus que les 87 kg des sujets de l’étude Moore et coll., 2009a) pourraient avoir besoin de plus de protéines que les athlètes qui pèsent moins pour maximiser la synthèse des protéines musculaires.
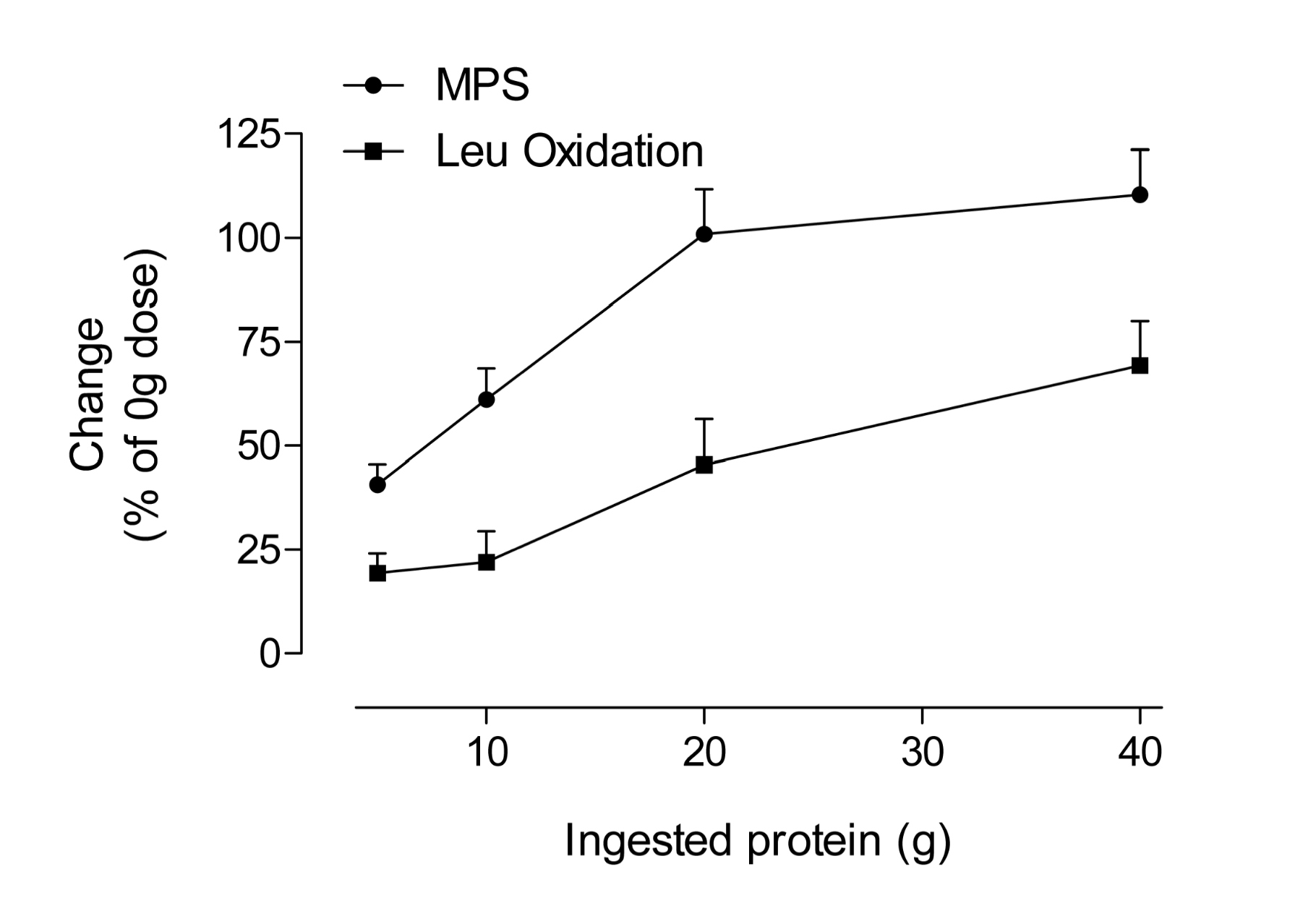
Figure 2 : Pourcentage d'augmentation (à partir de la valeur de base ou 0 g) de la synthèse des protéines musculaires et de l’oxydation de leucine après un exercice contre résistance chez de jeunes hommes en fonction de la quantité de protéines ingérées et de la dose de leucine. Les protéines ingérées étaient constituées d’un isolat de protéines d’œuf; données tirées de (Moore et coll., 2009a).
SURALIMENTATION ET INTERACTIONS AVEC L’EXERCICE
Les effets de l’exercice contre résistance sont puissants et durent longtemps avec un taux de synthèse des protéines musculaires restant élevé pendant au moins 48 heures (Phillips et coll., 1997) si le sujet est à jeun. Il a été montré plus d'une fois qu'un apport en protéines dès la fin d'un exercice stimule davantage la synthèse des protéines musculaires (Breen et Phillips, 2012; Churchward-Venne et coll., 2012). Même jusqu’à 24 heures après l’exercice contre résistance, les muscles restent sensibles aux effets ressentis et montrent une augmentation de la synthèse des protéines musculaires en réaction à une concentration plus élevée d’acides aminés dans le sang (Burd et coll., 2011). Il est donc normal de supposer qu’une plus grande sensibilité se manifesterait même au-delà de 24 heures (Figure 3).
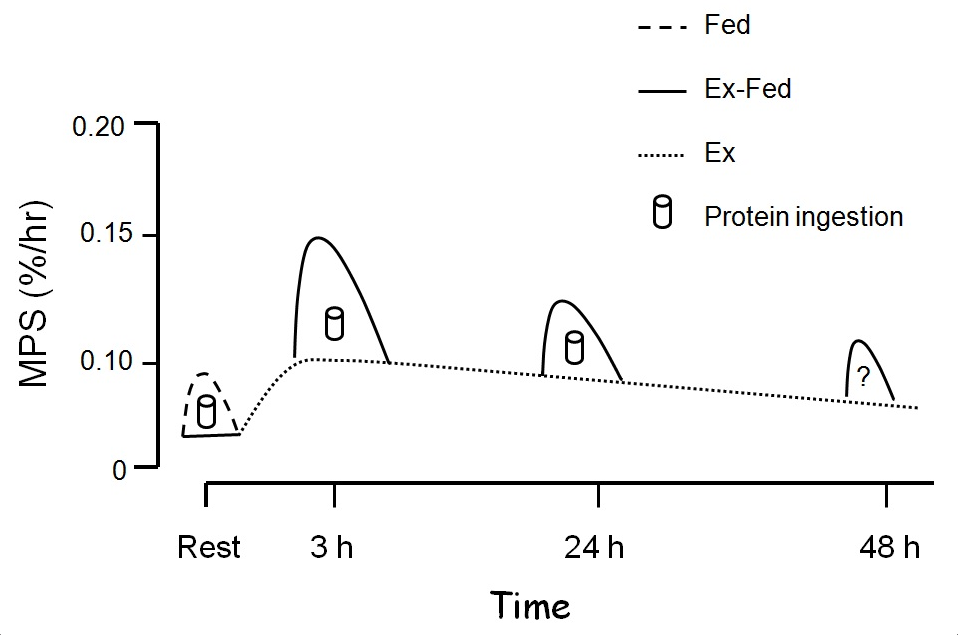
Figure 3 : L’exercice contre résistance favorise une augmentation soutenue de la synthèse des protéines musculaires, qui reste élevée pendant ≥ 24 heures (lignes pointillées). Nous pensons donc que pendant toute cette période où le « potentiel anabolique » est amélioré, l’effet d'un apport en protéines vient s'ajouter au taux déjà élevé induit par l’exercice (ligne continue).
Comme le montre la Figure 3, la « période propice » pour la consommation de protéines est plus longue qu'on aurait pu le croire. Néanmoins, un apport en protéines proche du moment de l’exercice pourrait avoir des avantages.
MOMENT DE L’INGESTION DES PROTÉINES
Il y a une explication physiologique à la stimulation exercée par une grande consommation de protéines proche du moment de l’exercice contre résistance sur la synthèse de protéines musculaires et l’acquisition de masse musculaire maigre (Hartman et coll., 2007; Holm et coll., 2006). Augmenter la concentration d’acides aminés dans le sang tout en effectuant un exercice contre résistance « tire avantage » des mécanismes cellulaires activés après l'exercice (Philp et coll., 2011). Il a été montré que l'allégation selon laquelle la consommation de protéines (ou d’acides aminés), et non simplement un supplément énergétique sous forme de glucides, peu après l’exercice contre résistance joue un rôle primordial pour obtenir une hypertrophie musculaire plus importante (Hartman et coll., 2007; Holm et coll., 2006). Ces études portant sur l’entraînement continu indiquent que la « période propice » pour consommer des protéines ou des acides aminés se situe probablement moins de 2 heures après l’exercice afin de permettre une plus grande augmentation de masse corporelle maigre et de l'hypertrophie musculaire chez les jeunes gens. Il convient de noter que dans une étude sur la consommation massive d’acides aminés sous forme cristalline, les muscles squelettiques ont eu une réaction anabolique complète chez de jeunes sujets tant 1 h que 3 h après l’exercice (Rasmussen et coll., 2000). Toutefois, aucune étude n’a vérifié si ce type d'apport se traduirait par une hypertrophie musculaire comparable dans le cas d'un entraînement. Par conséquent, pour favoriser à tout âge une plus grande hypertrophie lors d'un entraînement contre résistance, il serait avantageux de consommer une source de protéines dans l’heure qui suit la fin de l’exercice. Dans des études sur l’entraînement à long terme, une alimentation dès la fin de l’exercice (ou du moins peu de temps après) semble avoir pour effet d’améliorer le gain en masse musculaire (Hartman et coll., 2007; Holm et coll., 2006). Tipton et coll. (2001) ont porté une attention toute spéciale aux effets de l’alimentation avant un exercice et ont montré que la consommation d’acides aminés avant l'exercice plutôt qu'après entraîne un meilleur bilan net des acides aminés après l’exercice. Il est toutefois important de souligner que deux études ultérieures (Fujita et coll., 2009; Tipton et coll., 2006) n’ont pas été en mesure de reproduire l’effet stimulateur de l’alimentation avant l’exercice (Tipton et coll., 2001). Par conséquent, à l'heure actuelle, la question de savoir si manger avant un exercice peut effectivement améliorer l’anabolisme après l'exercice reste équivoque.
SOURCE DE PROTÉINES : INCIDENCE SUR LA SYNTHÈSE DES PROTÉINES MUSCULAIRES
Des études pointues au cours desquelles les sujets ont consommé des protéines de lait entier ou de soya (Elliot et coll., 2006; Wilkinson et coll., 2007) seules ou comme supplément (Tipton et coll., 2004; Tipton et coll., 2006) ont toutes révélé que ces protéines peuvent soutenir l’accrétion des protéines musculaires après un exercice contre résistance. Ces études ont comparé la capacité du lait liquide écrémé (237 ml, 377 kJ, 8,8 g de protéines), du lait entier (237 ml, 627 kJ, 8,0 g de protéines) et d'une quantité de lait écrémé isoénergétique au lait entier (393 ml, 626 kJ, 14,5 g de protéines) à favoriser le développement musculaire après un exercice (Elliot et coll., 2006). Elles ont révélé que le lait entier entraîne une augmentation de l’apport net en thréonine dans la jambe, et une tendance semblable pour la phénylalanine, ce qui suggère que le lait entier est plus efficace que le lait liquide écrémé pour favoriser le développement de la masse musculaire après un exercice. Les conséquences à long terme de la consommation de lait écrémé en quantités isoazotées plutôt que du lait entier suggèrent que le lait entier devrait favoriser une plus grande accrétion des protéines musculaires, mais le manque d’études à long terme nous empêche de tirer une telle conclusion à l'heure actuelle. Une étude (Wilkinson et coll., 2007) révèle que le lait liquide écrémé (500 ml, 745 kJ, 18,2 g de protéines) procure un plus grand bilan net et une synthèse fractionnaire des protéines musculaires plus rapide qu'une boisson isoénergétique et isoazotée de protéines de soya dont la composition en macronutriments est équivalente à celle du lait. Ces résultats pourraient s'expliquer en raison des différences dans la vitesse de digestion des protéines qui engendre une plus grande concentration des acides aminés dans le sang, pour ensuite influer sur l’anabolisme des protéines musculaires. Cette conclusion est confirmée par les données d’autres études portant sur la façon différente dont les protéines de lait et de soya sont réparties pour être utilisées dans les tissus splanchniques et périphériques, c’est-à-dire les muscles (Fouillet et coll., 2002). Plus précisément, les protéines de soya favorisent une plus grande synthèse des protéines splanchniques et sont converties en urée dans une plus grande mesure que les protéines du lait (Fouillet et coll., 2002). L’hydrolysat des protéines du lactosérum est rapidement digéré et se révèle plus efficace que le soya ou la caséine micellaire (forme de caséine présente dans le lait) pour stimuler la synthèse des protéines musculaires tant au repos qu’après l’exercice contre résistance; la réaction observée à cette synthèse est proportionnelle au pic de concentration de la leucine (Tang et coll., 2009). L’étude de Pennings et coll., 2011 a récemment corroboré ces faits avec des résultats virtuellement équivalents en ce qui concerne l’ingestion de lactosérum. Ces données (Pennings et coll., 2011; Tang et coll., 2009) ont mené à l’hypothèse de la leucine comme « déclencheur » (Figure 4), selon laquelle - pour le dire simplement - les protéines digérées plus rapidement et dont la teneur en leucine est plus élevée favorisent plus efficacement une augmentation de la synthèse des protéines musculaires (Breen et Phillips, 2012; Churchward-Venne et coll., 2012).
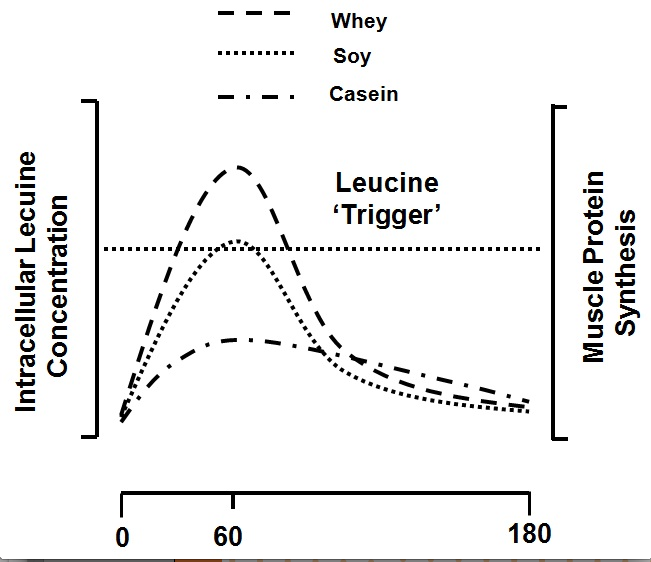
Figure 4 : La leucine comme « déclencheur », avec données tirées de (Tang et coll., 2009) pour les protéines de lactosérum, de soya et la caséine. Ces protéines seraient digérées dans l’ordre suivant : le lactosérum ≥ le soya >> la caséine, et selon la teneur suivante en leucine : le lactosérum > la caséine > le soya. Ainsi, une hausse plus élevée et plus rapide de la concentration de leucine dans le sang déclenche une plus forte augmentation de la synthèse des protéines musculaires.
Il faut reconnaître le rôle prépondérant joué par les protéines, qui permettent l’adaptation et la récupération au même titre que l’hydratation et l’apport en glucides. Un apport très élevé en protéines ne semble pas contribuer à une meilleure adaptation et pourrait même nuire à l’apport d’autres nutriments importants, comme les glucides. Les athlètes devraient être en mesure de maximiser la récupération de leurs muscles, et sans doute aussi celle des tissus conjonctifs, s'ils respectent les recommandations émises ici tout en accordant une attention particulière à la consommation de protéines après l'exercice et ainsi performer aux meilleures de leurs possibilités.
APPLICATIONS PRATIQUES - Consommez des protéines après l’exercice afin de maximiser la synthèse des protéines et favoriser l’adaptation.
- Il est préférable de prendre les protéines sous forme liquide parce qu'elles sont ainsi digérées plus rapidement.
- Les protéines rapidement digérées, comme le lactosérum, les protéines de lait ou le soya, sont les meilleures et semblent être les plus efficaces sous forme d'isolats.
- La protéine de lactosérum, en raison de sa teneur en leucine, représente la meilleure source de protéines par unité de masse pour stimuler la synthèse de nouvelles protéines musculaires.
- Consommez des protéines toute la journée à intervalles réguliers (20 à 25 g par repas ou 0,25 à 0,30 g de protéines/kg masse corporelle/repas) afin de maximiser la réaction anabolique.
- Il n’est pas nécessaire de prendre de grandes quantités de protéines pour augmenter la performance, car environ 1,2 à 1,6 g de protéines/kg/jour est adéquat et plus que suffisant pour la plupart des athlètes, même pendant un entraînement intensif.
REFERENCES
Biolo, G., K. D. Tipton, S. Klein, and R. R. Wolfe (1997). An abundant supply of amino acids enhances the metabolic effect of exercise on muscle protein. Am. J. Physiol. 273: E122-E129.
Bohe, J., J. F. Low, R. R. Wolfe, and M. J. Rennie (2001). Latency and duration of stimulation of human muscle protein synthesis during continuous infusion of amino acids. J. Physiol. 532: 575-579.
Bohe, J., A. Low, R. R. Wolfe, and M. J. Rennie (2003). Human muscle protein synthesis is modulated by extracellular, not intramuscular amino acid availability: a dose-response study. J. Physiol. 552: 315-324.
Breen, L., and S. M. Phillips (2012). Nutrient interaction for optimal protein anabolism in resistance exercise. Curr. Opin. Clin. Nutr. Metab. Care 15: 226-232.
Burd, N.A., D. W. West, D. R. Moore, P. J. Atherton, A. W. Staples, T. Prior, J. E. Tang, M. J. Rennie, S. K. Baker, and S. M. Phillips (2011). Enhanced amino acid sensitivity of myofibrillar protein synthesis persists for up to 24 h after resistance exercise in young men. J. Nutr. 141: 568-573.
Churchward-Venne, T.A., N. A. Burd, and S. M. Phillips (2012). Nutritional regulation of muscle protein synthesis with resistance exercise: strategies to enhance anabolism. Nutr. Metab. (Lond.) 9: 40.
Cuthbertson, D., K. Smith, J. Babraj, G. Leese, T. Waddell, P. Atherton, H. Wackerhage, P. M. Taylor, and M. J. Rennie (2005). Anabolic signaling deficits underlie amino acid resistance of wasting, aging muscle. FASEB J. 19: 422-424.
Elliot, T.A., M. G. Cree, A. P. Sanford, R. R. Wolfe, and K. D. Tipton (2006). Milk ingestion stimulates net muscle protein synthesis following resistance exercise. Med. Sci. Sports Exerc. 38: 667-674.
Fouillet, H., F. Mariotti, C. Gaudichon, C. Bos, and D. Tome (2002). Peripheral and splanchnic metabolism of dietary nitrogen are differently affected by the protein source in humans as assessed by compartmental modeling. J. Nutr. 132: 125-133.
Fujita, S., H. C. Dreyer, M. J. Drummond, E. L. Glynn, J. G. Cadenas, F. Yoshizawa, E. Volpi, and B. B. Rasmussen (2007). Nutrient signalling in the regulation of human muscle protein synthesis. J. Physiol. 582: 813-823.
Fujita, S., H. C. Dreyer, M. J. Drummond, E. L. Glynn, E. Volpi, and B. B. Rasmussen (2009). Essential amino acid and carbohydrate ingestion before resistance exercise does not enhance postexercise muscle protein synthesis. J. Appl. Physiol. 106: 1730-1739.
Glass, D.J. (2010). Signaling pathways perturbing muscle mass. Curr. Opin. Clin. Nutr. Metab. Care 13: 225-229.
Hartman, J.W., J. E. Tang, S. B. Wilkinson, M. A. Tarnopolsky, R. L. Lawrence, A. V. Fullerton, and S. M. Phillips (2007). Consumption of fat-free fluid milk after resistance exercise promotes greater lean mass accretion than does consumption of soy or carbohydrate in young, novice, male weightlifters. Am. J. Clin. Nutr. 86: 373-381.
Holm, L., B. Esmarck, M. Mizuno, H. Hansen, C. Suetta, P. Holmich, M. Krogsgaard, and M. Kjaer (2006). The effect of protein and carbohydrate supplementation on strength training outcome of rehabilitation in ACL patients. J. Orthop. Res. 24:2114-2123.
Karlsson, H.K., P. A. Nilsson, J. Nilsson, A. V. Chibalin, J. R. Zierath, and E. Blomstrand (2004). Branched-chain amino acids increase p70S6k phosphorylation in human skeletal muscle after resistance exercise. Am. J. Physiol. 287: E1-E7.
Mitchell, C.J., T. A. Churchward-Venne, D. D. West, N. A. Burd, L. Breen, S. K. Baker, and S. M. Phillips (2012). Resistance exercise load does not determine training-mediated hypertrophic gains in young men. J Appl. Physiol. 113:71-77.
Moore D.R., M. J. Robinson, J. L. Fry, J. E. Tang, E. I. Glover, S. B. Wilkinson, T. Prior, M. A. Tarnopolsky, and S. M. Phillips (2009a). Ingested protein dose response of muscle and albumin protein synthesis after resistance exercise in young men. Am. J. Clin. Nutr. 89: 161-168.
Moore, D.R., J. E. Tang, N. A. Burd, T. Rerecich, M. A. Tarnopolsky, and S. M. Phillips (2009b). Differential stimulation of myofibrillar and sarcoplasmic protein synthesis with protein ingestion at rest and after resistance exercise. J. Physiol. 597: 897-904.
Pennings, B., Y. Boirie, J. M. Senden, A. P. Gijsen, H. Kuipers, and L. J. van Loon (2011). Whey protein stimulates postprandial muscle protein accretion more effectively than do casein and casein hydrolysate in older men. Am. J. Clin. Nutr. 93: 997-1005.
Phillips, S.M., K. D. Tipton, A. Aarsland, S. E. Wolf, and R. R. Wolfe (1997). Mixed muscle protein synthesis and breakdown after resistance exercise in humans. Am. J. Physiol. 273: E99-E107.
Phillips, S.M., E. I. Glover, and M. J. Rennie (2009). Alterations of protein turnover underlying disuse atrophy in human skeletal muscle. J. Appl. Physiol. 107: 643-654.
Philp A., D. L. Hamilton, and K. Baar (2011). Signals mediating skeletal muscle remodeling by resistance exercise: PI3-kinase independent activation of mTORC1. J. Appl. Physiol. 110: 561-568.
Rasmussen, B.B., K. D. Tipton, S. L. Miller, S. E. Wolf, and R. R. Wolfe (2000). An oral essential amino acid-carbohydrate supplement enhances muscle protein anabolism after resistance exercise. J. Appl. Physiol. 88: 386-392.
Tang, J.E., D. R. Moore, G. W. Kujbida, M. A. Tarnopolsky, and S. M. Phillips (2009). Ingestion of whey hydrolysate, casein, or soy protein isolate: effects on mixed muscle protein synthesis at rest and following resistance exercise in young men. J. Appl. Physiol. 107: 987-992.
Tipton, K.D., A. A. Ferrando, S. M. Phillips, D. Doyle, Jr., and R. R. Wolfe (1999). Postexercise net protein synthesis in human muscle from orally administered amino acids. Am. J. Physiol. 276: E628-E634.
Tipton, K.D., B. B. Rasmussen, S. L. Miller, S. E. Wolf, S. K. Owens-Stovall, B. E. Petrini, and R. R. Wolfe (2001). Timing of amino acid-carbohydrate ingestion alters anabolic response of muscle to resistance exercise. Am. J. Physiol. 281: E197-E206. Tipton, K.D., T. A. Elliott, M. G. Cree, S. E. Wolf, A. P. Sanford, and R. R. Wolfe (2004). Ingestion of casein and whey proteins result in muscle anabolism after resistance exercise. Med. Sci. Sports Exerc. 36: 2073-2081.
Tipton, K.D., T. A. Elliott, M. G. Cree, A. A. Aarsland, A. P. Sanford, and R. R. Wolfe (2006). Stimulation of Net Muscle Protein Synthesis by Whey Protein Ingestion Before and After Exercise. Am. J. Physiol. 292: E71-E76.
Volpi, E., H. Kobayashi, M. Sheffield-Moore, B. Mittendorfer, and R. R. Wolfe (2003). Essential amino acids are primarily responsible for the amino acid stimulation of muscle protein anabolism in healthy elderly adults. Am. J. Clin. Nutr. 78: 250-258.
Wilkinson, S.B., M. A. Tarnopolsky, M. J. MacDonald, J. R. Macdonald, D. Armstrong, and S. M. Phillips (2007). Consumption of fluid skim milk promotes greater muscle protein accretion following resistance exercise than an isonitrogenous and isoenergetic soy protein beverage. Am. J. Clin. Nutr. 85: 1031-1040.