Keith Baar and Lisa E. Heaton
POINTS PRINCIPAUX
-
Le football est un sport très intense par intermittence pouvant causer des lésions aux muscles, au cartilage et aux os, des dommages qui doivent être minimisés pour que les joueurs soient en bonne santé à la fin de l’année.
-
La clé d’une fonction musculaire optimale est de maximiser le renouvellement des protéines tout en maintenant un bilan protéique positif.
-
La régénération des muscles endommagés dépend d’un complexe de protéine kinase appelé mécanisme du complexe 1 de la cible mammalienne de la rapamycine (mTORC1).
-
Le mTORC1 peut être activé par un régime alimentaire riche en protéines à absorption rapide et riche en leucine, un acide aminé, et être inactivé par la consommation d’alcool.
-
Les acides gras oméga-3 peuvent améliorer la synthèse des protéines musculaires, diminuer l’inflammation et améliorer la fonction cognitive.
-
Une récente méta-analyse a révélé que les taux de vitamine D circulante (< 32 ng/ml) de plus de 50 % des athlètes, quelle que soit leur origine ethnique, étaient insuffisants. Une observation qui a son importance puisqu’un taux de vitamine D adéquat améliore les fonctions musculaires, osseuses et immunitaires.
-
Les athlètes à la peau foncée sont exposés à un plus grand risque d’insuffisance ou de carence en vitamine D parce qu’ils ne synthétisent pas aussi efficacement la vitamine D provenant d’une exposition au soleil.
-
Nous présentons donc ici une stratégie nutritionnelle toute simple qui peut être utilisée pour maximiser la récupération pendant une saison de football.
EXIGENCES FONCTIONNELLES DU FOOTBALL
En plus des exigences métaboliques du football dont le SSE 143 fait l’objet, le coût des dommages physiques associés au football peut être considérablement élevé. L’une des façons de l’évaluer est de mesurer le taux de créatine kinase (CK) libérée dans le sang en cas de dommages musculaires (Zimmerman et Shen, 2013). Après les parties de football, les taux sanguins de CK augmentent progressivement pendant toute la saison (Kraemer et coll., 2013), révélant le coût cumulatif d’une saison de football pour la santé des muscles. Ce coût doit être réduit au minimum pour que la performance des joueurs soit la meilleure possible lors des parties de fin de saison, celles qui comptent le plus. En plus des dommages musculaires, pendant la récupération des joueurs, il faut aussi tenir compte des effets du jeu sur la santé du cartilage (Gray et coll., 2013) et des os (Mall et coll., 2012).
Comme c’est le cas pour tous les sports d’élite, les principales approches pour protéger un athlète des blessures et maximiser sa performance consistent à optimiser son entraînement et sa récupération. Cet article porte sur des principes alimentaires assurant la meilleure récupération possible et met surtout l’accent sur les produits alimentaires qui peuvent aider un athlète à bien se préparer à une partie et à bien récupérer après chaque partie d’une saison de football éprouvante.
RÉCUPÉRATION MÉTABOLIQUE À L’AIDE DU RÉGIME ALIMENTAIRE
Jouer au football épuise surtout les réserves de glycogène, ce qui peut causer une déshydratation. Par conséquent, dans les heures et les jours qui suivent une partie, et au cours des jours qui précèdent une partie, il faut d’abord et avant tout récupérer et emmagasiner autant de glycogène et de liquide que possible. La récupération de glycogène, un apport calorique adéquat, la dégradation des macronutriments, le moment de l’apport en nutriments et les besoins alimentaires des joueurs de football pendant une saison, ainsi que la façon de soutenir la meilleure performance athlétique possible font l’objet de l’article SSE 146; l’article SSE 141 porte sur l’optimisation de l’équilibre hydrique. Le présent article porte donc, en particulier, sur les nutriments qui sont nécessaires pour préserver la santé des muscles, des os, du cartilage, du cerveau et du système immunitaire pendant une saison de football.
RÉCUPÉRATION MUSCULAIRE – MAXIMISER LE RENOUVELLEMENT EN PROTÉINES
La clé pour préserver à long terme la santé musculaire est la capacité à augmenter rapidement le renouvellement des protéines en réponse aux traumatismes et à préserver le bilan protéique. Pour maximiser le renouvellement des protéines, il faut favoriser tant la synthèse que la dégradation des protéines dans le muscle, ce qui assure une meilleure fonction musculaire (Hwee et coll., 2014). Pendant une saison de football, il est essentiel de favoriser le renouvellement des protéines afin de réparer les fibres musculaires endommagées pendant l’entraînement ou les parties (Kraemer et coll., 2013). Les protéines se dégradent pour remplacer les fibres musculaires endommagées et stimuler la réparation des muscles. Par conséquent, la dégradation des protéines est proportionnelle à la synthèse protéique (Phillips et coll., 1997), et les athlètes entraînés peuvent recycler les acides aminés libérés par la dégradation des protéines dans un muscle endommagé (Phillips et coll., 1999), ce qui se traduit par des muscles plus gros et plus forts si le taux de renouvellement est élevé (Hwee et coll., 2014).
D’un autre côté, le bilan protéique est la différence arithmétique entre le taux de synthèse et le taux de dégradation des protéines. Pour qu’un muscle conserve sa taille, le bilan protéique doit être égal à zéro, pour que le muscle grossisse, il doit être positif et pour que sa taille diminue, il doit être négatif. Pour conserver force, vitesse et agilité pendant toute une saison de football physiquement éprouvante, chaque joueur doit essayer de maintenir son bilan protéique aussi près que possible de zéro.
Le football peut être considéré comme une série de contractions et d’étirements à contrainte élevée avec un biais excentrique. Autrement dit, jouer au football, c’est comme faire une longue et difficile série d’exercices contre résistance, dont beaucoup de mouvements excentriques ou pliométriques. En d’autres termes, c’est un stimulus par des lésions qui permet aux muscles de grossir et de se renforcer à condition que le temps de récupération soit optimal. Nous savons qu’après les exercices contre résistance, la synthèse et la dégradation des protéines musculaires augmentent (Phillips et coll., 1997). Si l’exercice est effectué à jeun, la dégradation des protéines est plus importante que leur synthèse et le résultat net est une dégradation des protéines musculaires (Tipton et coll., 1999). Pour que le bilan protéique dans le muscle revienne à zéro ou devienne positif, l’athlète doit consommer des protéines, surtout des protéines riches en acides aminés essentiels (Tipton et coll., 1999).
Un complexe protéique appelé complexe 1 de la cible mammalienne de la rapamycine (mTORC1) joue un rôle primordial tant pour la régénération du muscle après une lésion que pour l’augmentation de la synthèse des protéines après l’exercice. Après des exercices contre résistance, le taux de développement musculaire est directement proportionnel à l’activité de mTORC1 (Baar et Esser, 1999) et l’activité de mTORC1 est nécessaire pour que les exercices contre résistance (Drummond et coll., 2009) ou les acides aminée (Dickinson et coll., 2011) permettent une augmentation de la synthèse des protéines De plus, mTORC1 est aussi nécessaire pour que le muscle se régénère après une blessure (Ge et coll., 2009). Par conséquent, pour que le muscle se régénère et se renforce après avoir été endommagé pendant une partie de football, le complexe mTORC1 doit être activé.
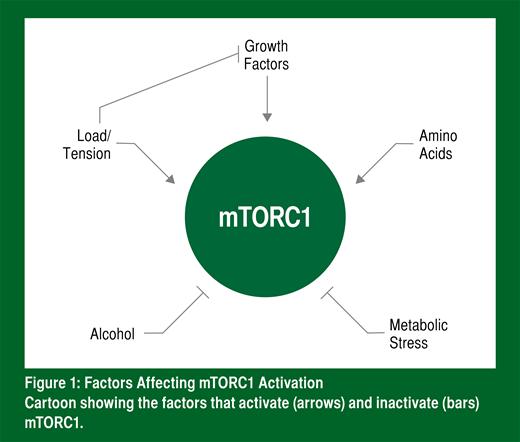
De façon générale, le complexe mTORC1 peut être activé de trois façons : 1) par l’exercice; 2) par les hormones ou facteurs de croissance; 3) par les acides aminés (Figure 1). Les exercices intenses bloquent la capacité des facteurs de croissance à activer mTORC1, mais activent directement mTORC1 (Hamilton et coll., 2014). Les acides aminés (des aliments) et les exercices intenses (jeux, séances d’entraînement ou exercices de force et conditionnement physique) activent le complexe mTORC1 de différentes façons et, par conséquent, leurs effets s’ajoutent les uns aux autres. Pendant la saison d’un joueur de football, cela signifie qu’il y a en pratique deux façons d’activer le complexe mTORC1. De façon plus précise, mTORC1 est activé par des charges élevées jusqu’à l’échec (Baar et Esser, 1999) et par l’acide aminé qu’est la leucine (Moberg et coll., 2014). Même si tous les autres acides aminés sont nécessaires pour augmenter la synthèse des protéines (Churchward-Venne et coll., 2012), la leucine est le déclencheur qui active mTORC1 et qui permet d’obtenir un bilan protéique positif (Breen et Churchward-Venne, 2012). Par conséquent, afin d’activer mTORC1 et pour maximiser la régénération musculaire et le bilan protéique, le régime alimentaire des athlètes doit contenir des protéines riches en leucine.
D’un autre côté, mTORC1 peut être inactivé de deux façons : 1) par l’alcool et 2) en raison d’un stress métabolique. Un taux sanguin d’alcool de 0,06 g/100 ml suffit à faire diminuer la synthèse des protéines musculaires après l’exercice, ce qui est probablement dû à une moins forte activité de mTORC1 (Parr et coll., 2014). Comme l’activation de mTORC1 est nécessaire pour que le muscle se répare de façon adéquate, si l’athlète consomme de l’alcool après une partie ou une séance d’entraînement éprouvante, il ne récupérera probablement pas de façon adéquate ou sa récupération accusera un retard considérable. Tout comme l’alcool, le stress métabolique associé aux séances d’entraînement par intervalles et à haute intensité (Coffey et coll., 2009) ou un déficit énergétique (Pasiakos et coll., 2014) peuvent faire diminuer l’activité du complexe mTORC1 et la synthèse des protéines musculaires. Par conséquent, pendant la saison, les athlètes doivent s’efforcer de maintenir leur bilan énergétique, et l’entraînement de force ne devrait jamais être effectué tout de suite avant ou tout de suite après une séance d'entraînement.
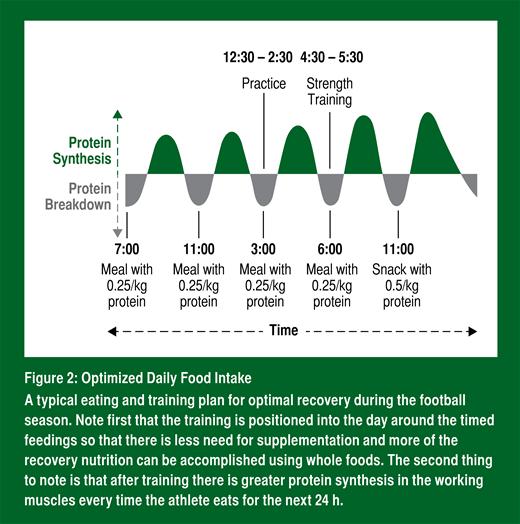
Au-delà des principes de base selon lesquels les aliments riches en leucine et le complexe mTORC1 contribuent à optimiser l’équilibre des protéines et la récupération pendant une saison de football, la quantité exacte de l’apport en protéines et le moment auquel il convient de les prendre sont aussi connus. Pour maximiser la synthèse des protéines, un athlète doit consommer des protéines riches en leucine à raison de 0,25 g/kg de masse corporelle, tout de suite après un entraînement (Moore et coll., 2009) et toutes les 4 h environ pendant la journée. Le choix de cette quantité repose sur le fait que prendre davantage de protéines ne permet pas de faire augmenter davantage leur synthèse, ce qui signifie par ailleurs que prendre une plus grande quantité de protéines, mais moins souvent, ne peut remplacer des repas à intervalles réguliers contenant la quantité optimale de protéines (Areta et coll., 2013); (Figure 2).
ACIDES GRAS OMÉGA-3 ET RÉCUPÉRATION
Un acide gras oméga-3 est un acide gras polyinsaturé, ce qui signifie qu’il contient deux ou plus de liaisons doubles, l’une des liaisons doubles étant au troisième atome de carbone de l’extrémité méthyle. Ces acides gras polyinsaturés sont considérés comme essentiels parce que l’organisme humain ne peut pas les fabriquer en quantités appréciables.
Parlons maintenant de deux acides gras oméga-3 à longue chaîne : l’acide eicosapentaénoïque (EPA) et l’acide docosahexanoïque (DHA). D’autres acides gras oméga-3, comme l’acide α/γ-linolénique (ALA), peuvent être convertis en EPA et en DHA dans l’organisme. Mais les taux de conversion de l’ALA en EPA et en DHA chez les hommes jeunes sont d’environ 8 % et de 0 à 4 %, respectivement (Burdge et coll., 2002).
Les acides gras oméga-3 font l’objet d’un grand nombre de recherches sur la performance, puisqu’il est reconnu qu’ils pénètrent dans les membranes cellulaires, améliorent la synthèse des protéines musculaires, diminuent l’inflammation et améliorent la fonction cognitive. Tous ces effets ont des répercussions sur la performance et la santé des athlètes.
Synthèse des protéines musculaires
La majorité des études analysant les effets des acides gras oméga-3 sur la synthèse des protéines musculaires ont été menées auprès de populations âgées (> 60 ans) ou chez des animaux. Dans l’une de ces études, l’apport en acides gras oméga-3 a entraîné une plus grande activation de mTORC1 chez des adultes âgés recevant des perfusions de solution à haute teneur en insuline et en acides aminés (Smith et coll., 2011a). Dans une étude de suivi, les auteurs ont trouvé que la réponse anabolique à une perfusion d’insuline et d’acides aminés était supérieure après l’apport d’un supplément de 4 g d’acides gras oméga-3 à longue chaîne (y compris 1,86 g d’EPA, 1,50 g de DHA) tous les jours et pendant 8 semaines (Smith et coll., 2011b). Ces données confirment l’hypothèse selon laquelle, quand les niveaux d’insuline et d’acides aminés sont élevés, comme après un repas copieux, des quantités adéquates d’acides gras oméga-3 peuvent améliorer la synthèse des protéines musculaires en activant le complexe mTORC1. Ces données sont fort intéressantes, mais des recherches plus poussées sont nécessaires pour établir si ces résultats s’étendent aux athlètes d’élite.
Inflammation et douleurs musculaires
Jouer au football engendre un grand nombre de lésions musculaires, des dommages qui s’accumulent à mesure que la saison avance. L’une des réponses naturelles à ces dommages est une réaction inflammatoire dans le muscle, une réaction qui est nécessaire pour que le muscle s’adapte à l’entraînement (Koh et Pizza, 2009). Une trop forte inflammation peut toutefois compromettre la capacité de récupération du muscle après l’exercice. Les acides gras oméga-3 ont des propriétés anti-inflammatoires naturelles. Le DHA et l’EPA réduisent l’expression des cytokines inflammatoires et génèrent aussi une famille de médiateurs anti-inflammatoires appelés résolvines (Calder, 2006). Le DHA influence en particulier l’activité des cellules inflammatoires, altérant la prolifération des neutrophiles et la phagocytose des monocytes (Gogus, 2010).
L’un des résultats de ces effets anti-inflammatoires de l’EPA et du DHA est d’atténuer la douleur musculaire. Deux études ont montré l’effet direct d’un apport en oméga-3 sur la douleur musculaire d’apparition retardée (delayed onset muscle soreness ou DOMS) 48 h après l’exercice. Tartibian et ses collaborateurs (2009) ont donné à des sujets non entraînés 1,8 g/jour d’un supplément d’oméga-3 (contenant 0,324 g d’EPA et 0,216 g de DHA) pendant 30 jours avant qu’ils effectuent une séance d’exercice pliométrique. Les sujets qui ont pris le supplément d’oméga-3 ont rapporté une atténuation de la douleur perçue et, 48 h après l’exercice, et une amélioration de l’amplitude de mouvement du genou a été observée chez eux, même avec une dose aussi faible. Jouris et ses collaborateurs (2011) ont montré de façon similaire une réduction de la DOMS après une supplémentation en oméga-3 (contenant 2 g d’EPA, 1 g de DHA par jour) 48 h après un protocole d’exercices pliométriques. Ces résultats intéressants suggèrent que même de petites quantités d’acides gras oméga-3 peuvent faire diminuer la DOMS. D’autres recherches chez des sujets très entraînés restent nécessaires, mais l’apport d’oméga-3 semble avoir le potentiel d’améliorer la récupération musculaire.
Fonction cognitive
Le DHA joue un rôle très particulier et essentiel dans le fonctionnement du tissu neuronal (Dyall et Michael-Titus, 2008). Dans la structure de la bicouche phospholipidique des neurones, le DHA est l’acide gras oméga-3 qui prévaut et il participe aussi à la synthèse des neuroprotectines (molécules antioxydantes, antiapoptotiques et anti-inflammatoires). La prévalence du DHA dans les tissus neuronaux a des effets sur les facultés cognitives, la mémoire et la capacité d’apprentissage. Tous ces facteurs ont des répercussions sur la pratique des sports d’équipe comme le football. Par exemple, quand Fontani et ses collaborateurs (2005) ont donné à de jeunes sujets adultes un supplément de 4 g/jour d’oméga-3 (contenant 1,6 g d’EPA et 0,8 g de DHA) pendant 35 jours, ils ont remarqué que les sujets obtenaient de meilleurs résultats aux tests cognitifs, que leur temps de réaction était plus rapide et leur attention plus longue. C’est l’une des raisons pour lesquelles les suppléments en oméga-3 (notamment en DHA) jouent de nos jours un rôle important dans les protocoles de réadaptation après un traumatisme crânien (commotion cérébrale).
Sources d’oméga-3 et recommandations en matière de supplémentation
L’ALA est un oméga-3 provenant de sources végétales, comme les graines de lin, l’huile de lin, les noix, les beurres de noix, les algues, les graines, l’huile de soya et l’huile de canola. L’EPA et le DHA sont des acides gras oméga-3 de sources animales, comme les poissons gras d’eaux froides (comme le thon et le saumon), les huiles de poisson et l’huile de krill. Il existe aussi une grande variété de suppléments d’oméga-3. Il est important pour un athlète de noter qu’il y a une différence entre les « grammes d’huile de poisson » et les « grammes d’EPA/DHA » sur l’étiquette d’un supplément.
Le United States Institute of Medicine recommande que l’apport quotidien en ALA soit de 1,6 g par jour pour les hommes. Aucune recommandation n’a été faite pour l’apport en EPA et en DHA, même si l’American Heart Association a émis des lignes directrices relatives à l’apport en EPA et en DHA (Kris-Etherton et coll., 2002) (Tableau 1).

Compte tenu de l’importance des acides gras oméga-3 pour la récupération, le système immunitaire et la fonction cérébrale, les athlètes qui n’ont pas de problèmes de saignement devraient consommer 3 g/jour d’acides gras oméga-3 avec environ 0,75 g d’EPA et 1 g de DHA, le reste provenant de sources végétales.
VITAMINE D
Taux sériques de vitamine D
Selon une récente analyse systématique et une méta-analyse des études portant sur le taux de vitamine D chez les athlètes, ces taux étaient adéquats (< 32 ng/ml) chez seulement la moitié (56 %) des athlètes (Farrokhyar et coll., 2015). En particulier, dans la National Football League, dans le cadre d’une étude menée auprès de 80 joueurs, les taux sériques de 55 joueurs étaient insuffisants (12 à 20 ng/ml) ou en déficit (< 12 ng/ml) en vitamine D (Maroon et coll., 2015). Les répercussions de taux insuffisants ou d’une carence en vitamine D sur la santé des os, du système immunitaire (Schwalfenberg, 2011), la fonction neuromusculaire, la croissance cellulaire et l’inflammation sont importantes (Ross et coll., 2011). Par conséquent, il est essentiel d’effectuer des tests sanguins pendant toute la saison pour détecter tout problème éventuel avant qu’il ne se développe.
Santé musculosquelettique et récupération
Le rôle de la vitamine D dans la santé musculosquelettique est bien établi et est à la base de l’apport nutritionnel recommandé pour cette vitamine. La vitamine D favorise l’absorption du calcium dans le petit intestin et joue un rôle important dans l’homéostasie du calcium ainsi que dans la minéralisation des os (Ross et coll., 2011). Le calcium joue aussi un rôle important dans le muscle, dans lequel la libération de calcium déclenche la contraction musculaire. Par conséquent, il n’est pas surprenant qu’une carence en vitamine D soit associée à une force musculaire réduite chez les personnes âgées (Campbell et Allain, 2006). La vitamine D peut aussi jouer un rôle important dans la régénération musculaire après une blessure. Srikuea et ses collaborateurs (2012) ont montré que même si le taux du récepteur de la vitamine D est faible dans le muscle adulte normal, pendant la récupération après une blessure, ce récepteur est fortement exprimé dans les noyaux des fibres en régénération. Ce résultat donne à penser que la vitamine D joue un rôle important dans la réparation du muscle, et il n’est pas étonnant que des taux plus élevés de vitamine D tendent à accroître l’hypertrophie musculaire après des exercices contre résistance.
Les résultats obtenus auprès de populations plus âgées confirment le rôle potentiel de la vitamine D pour favoriser la performance musculosquelettique. Toutefois, chez les athlètes des clubs sportifs, aucune amélioration importante n’a été observée lors des développés-couchés, des développés des jambes ou de la hauteur d’un saut vertical après 12 semaines de supplémentation en vitamine D (20 000 ou 40 000 UI/semaine) (Close et coll., 2013). Aucun avantage sur le plan de la performance n’a été observé même si les taux sériques de vitamine D (25(OH)D) ont augmenté de façon significative au cours de l’étude de 12 semaines. Par conséquent, il est peu probable que la vitamine D puisse améliorer la performance des athlètes de niveau élite.
Système immunitaire
Les récepteurs de la vitamine D s’expriment sur diverses cellules immunitaires (White, 2008). La vitamine D joue un rôle tant dans la réponse immunitaire innée que dans la réponse immunitaire adaptative, et des taux adéquats de vitamine D sont nécessaires pour préserver l’intégrité de la barrière et assurer la production d’antimicrobiens, la chimiotaxie et la régulation de la réaction inflammatoire. La saison de football se prolonge jusqu’en hiver, moment où, de façon générale, les taux de vitamine D baissent (Khare et coll., 2013), ce qui peut avoir un effet négatif sur la capacité à lutter contre les virus (Schwalfenberg, 2011). Si nous comprenons seulement depuis peu comment la vitamine D agit sur la santé du système immunitaire, il demeure que garder un joueur au jeu ou lui accorder un congé de maladie sont des aspects à prendre en considération au moment de décider s’il doit prendre des suppléments.
Sources de vitamine D
La vitamine D est une vitamine liposoluble, ce qui veut dire qu’il faut des matières grasses alimentaires pour qu’elle soit absorbée par l’intestin. Les sources alimentaires et naturelles de vitamine D, qui comprennent les poissons gras (thon, saumon, maquereau, etc.), l’huile de foie de poisson, le fromage, les jaunes d’œuf et le foie de bœuf, sont limitées (Ross et coll., 2011). Des aliments enrichis en vitamine D, dont le lait, le jus d’orange, les yogourts, la margarine et certaines céréales sont, d’autre part, largement disponibles (Ross et coll., 2011).
La vitamine D peut aussi être produite par voie endogène quand la peau est exposée aux rayons ultraviolets B (UVB). Toutefois, il est important de savoir si la vitamine D provenant d’une exposition au soleil peut suffire à un athlète. En automne, en hiver et au début du printemps, aux latitudes supérieures à 40o, les rayons UVB ne sont pas suffisamment ardents pour que la peau puisse absorber la vitamine D. De plus, quand la température est basse, les athlètes portent généralement plusieurs couches de vêtements, ce qui bloque l’exposition de la peau au soleil. Les athlètes qui passent beaucoup de temps à s’entraîner et à jouer à l’intérieur auront moins l’occasion de synthétiser de la vitamine D quelle que soit la période de l’année. L’utilisation d’un écran solaire bloque aussi l’absorption des rayons UVB et inhibe la production de vitamine D. La couleur de la peau a aussi un rôle important à jouer, puisque les peaux foncées ne synthétisent pas autant de vitamine D que les peaux claires. Compte tenu de ces limites, la plupart des joueurs de football ne produisent pas suffisamment de vitamine D par voie endogène et ont donc besoin d’un apport alimentaire de cette vitamine.
LIGNES DIRECTRICES PRATIQUES EN MATIÈRE DE NUTRITION FONDÉES SUR LA SCIENCE DE LA RÉCUPÉRATION
-
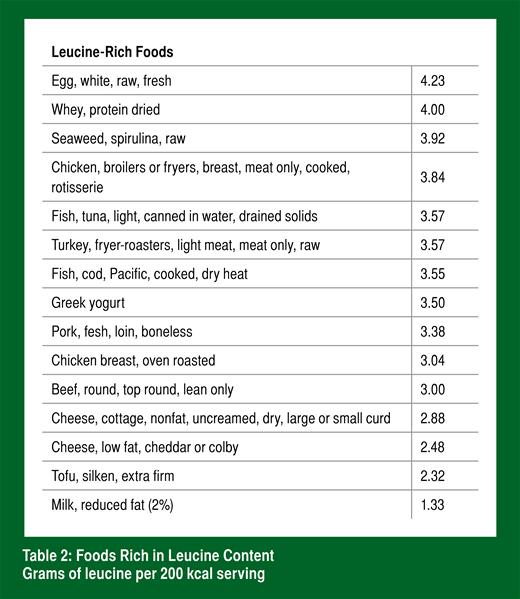
Tout de suite après une partie et une séance d’entraînement, prendre une source rapidement absorbable de protéines riches en leucine, un acide aminé. Le Tableau 2 donne des exemples de ce type d’aliments et inclut des produits laitiers (contenant notamment du lactosérum) et des œufs.
-
Pendant toute la saison, prendre des repas contenant 0,25 g/kg de masse corporelle de protéines riches en leucine dès le matin, puis toutes les 4 h au cours de la journée (Moore et coll., 2009). Moins de repas contenant plus de protéines n’est pas aussi bénéfique que cette façon de procéder, qui est optimale (Areta et coll., 2013).
-
Prendre 0,5 g/kg de masse corporelle de protéines riches en leucine juste avant d’aller au lit, ce qui favorise la synthèse des protéines pendant le sommeil et permet de conserver un bilan protéique positif pendant la nuit (Res et coll., 2012).
-
Les athlètes devraient prendre environ 3 g d’acides gras oméga-3 par jour, contenant environ 0,75 g d’EPA et 1 g de DHA. Idéalement, cette quantité d’acides gras oméga-3 doit provenir d’aliments entiers comme le thon et le saumon, les graines de lin, les noix et les beurres de noix. Une telle quantité d’acides gras oméga-3 peut aider l’athlète en favorisant la synthèse des protéines musculaires, en réduisant l’inflammation et en améliorant la fonction cognitive.
-
En cas d’insuffisance en vitamine D confirmée par des tests sanguins, un athlète devrait prendre environ 5 000 UI de vitamine D par jour. De plus, chez les joueurs américains d’origine africaine ou ceux qui s’entraînent et qui vivent au nord et dont la peau ne peut absorber autant de vitamine D qu’il le faudrait, un programme de supplémentation de ce type peut diminuer les infections et améliorer la récupération musculaire.
RÉFÉRENCES
Areta, J. L., L. M. Burke, M. L. Ross, D. M. Camera, D. W. West, E. M. Broad, N. A. Jeacocke, D. R. Moore, T. Stellingwerff, S. M. Phillips, J. A. Hawley, and V. G. Coffey (2013). Timing and distribution of protein ingestion during prolonged recovery from resistance exercise alters myofibrillar protein synthesis. J Physiol. 591: 2319-2331.
Baar, K., and K. Esser (1999). Phosphorylation of p70(S6k) correlates with increased skeletal muscle mass following resistance exercise. Am. J. Physiol. 276: C120-C127.
Breen, L., and T. A. Churchward-Venne (2012). Leucine: a nutrient 'trigger' for muscle anabolism, but what more? J. Physiol. 590: 2065-2066.
Burdge, G. C., A. E. Jones, and S. A. Wootton (2002). Eicosapentaenoic and docosapentaenoic acids are the principal products of alpha-linolenic acid metabolism in young men. Br. J. Nutr. 88: 355-363.
Calder, P. C. (2006). N-3 polyunsaturated fatty acids, inflammation, and inflammatory diseases. Am. J. Clin. Nutr. 83: 1505S-1519S.
Campbell, P. M., and T. J. Allain (2006). Muscle strength and vitamin D in older people. Gerontology 52: 335-338.
Churchward-Venne, T. A., N. A. Burd, C. J. Mitchell, D. W. West, A. Philp, G. R. Marcotte, S. K. Baker, K. Baar, and S. M. Phillips (2012). Supplementation of a suboptimal protein dose with leucine or essential amino acids: effects on myofibrillar protein synthesis at rest and following resistance exercise in men. J.Physiol 590: 2751-2765.
Close, G. L., J. Leckey, M. Patterson, W. Bradley, D. J. Owens, W. D. Fraser, and J. P. Morton (2013). The effects of vitamin D(3) supplementation on serum total 25[OH] D concentration and physical performance: a randomised dose-response study. Br J. Sports Med. 47: 692-696.
Coffey, V. G., B. Jemiolo, J. Edge, A. P. Garnham, S. W. Trappe, and J. A. Hawley (2009). Effect of consecutive repeated sprint and resistance exercise bouts on acute adaptive responses in human skeletal muscle. Am. J. Physiol. 297: R1441-R1451.
Dickinson, J. M., C. S. Fry, M. J. Drummond, D. M. Gundermann, D. K. Walker, E. L. Glynn, K. L. Timmerman, S. Dhanani, E. Volpi, and B. B. Rasmussen (2011). Mammalian target of rapamycin complex 1 activation is required for the stimulation of human skeletal muscle protein synthesis by essential amino acids. J. Nutr. 141: 856-862.
Drummond, M. J., C. S. Fry, E. L. Glynn, H. C. Dreyer, S. Dhanani, K. L. Timmerman, E. Volpi, and B. B. Rasmussen (2009). Rapamycin administration in humans blocks the contraction-induced increase in skeletal muscle protein synthesis. J. Physiol. 587: 1535-1546.
Dyall, S. C., and A. T. Michael-Titus (2008). Neurological benefits of Omega-3 fatty acids. Neuromol. Med .10: 219-235.
Farrokhyar, F., R. Tabasinejad, D. Dao, D. Peterson, O. R. Ayeni, R. Hadioonzadeh, and M. Bhandari (2015). Prevalence of Vitamin D Inadequacy in Athletes: A Systematic- Review and Meta-Analysis. Sports Med. 45:365-378.
Fontani, G., F. Corradeschi, A. Felici, F. Alfatti, S. Migliorini, and L. Lodi (2005). Cognitive and physiological effects of Omega-3 polyunsaturated fatty acid supplementation in healthy subjects. Eur J Clin Invest 35: 691-699.
Ge, Y., A. L. Wu, C. Warnes, J. Liu, C. Zhang, H. Kawasome, N. Terada, M. D. Boppart, C. J. Schoenherr, and J. Chen (2009). mTOR regulates skeletal muscle regeneration in vivo through kinase-dependent and kinase-independent mechanisms. Am. J. Physiol. 297: C1434-C1444.
Gogus, U. S. (2010). n-3 Omega fatty acids: a review of current knowledge. Int. J. Food Sci. Tech. 45: 417-436.
Gray, B. L., J. M. Buchowski, D. B. Bumpass, R. A. Lehman, Jr., N. A. Mall, and M. J. Matava (2013). Disc herniations in the National Football League. Spine 38: 1934- 1938.
Hamilton, D. L., A. Philp, M. G. MacKenzie, A. Patton, M. C. Towler, I. J. Gallagher, S. C. Bodine, and K. Baar (2014). Molecular brakes regulating mTORC1 activation in skeletal muscle following synergist ablation. Am. J. Physiol. 307: E365-E373.
Hwee, D. T., L. M. Baehr, A. Philp, K. Baar, and S. C. Bodine (2014). Maintenance of muscle mass and load-induced growth in Muscle RING Finger 1 null mice with age. Aging Cell 13: 92-101.
Jouris, K. B., J. L. McDaniel, and E. P. Weiss (2011). The effect of Omega-3 fatty acid supplementation on the inflammatory response to eccentric strength exercise. J. Sports Sci. Med. 10: 432-438.
Khare, D., N. M. Godbole, S. D. Pawar, V. Mohan, G. Pandey, S. Gupta, D. Kumar, T. N. Dhole, and M. M. Godbole (2013). Calcitriol [1, 25[OH]2 D3] pre- and post-treatment suppresses inflammatory response to influenza A (H1N1) infection in human lung A549 epithelial cells. Eur. J. Nutr. 52:1405-1415.
Koh, T. J. and F. X. Pizza (2009). Do inflammatory cells influence skeletal muscle hypertrophy? Front. Biosci. 1: 60-71.
Kraemer, W. J., D. P. Looney, G. J. Martin, N. A. Ratamess, J. L. Vingren, D. N. French, D. L. Hatfield, M. S. Fragala, B. A. Spiering, R. L. Howard, C. Cortis, T. K. Szivak, B. A. Comstock, C. Dunn-Lewis, D. R. Hooper, S. D. Flanagan, J. S. Volek, J. M. Anderson, C. M. Maresh, and S. J. Fleck (2013). Changes in creatine kinase and cortisol in National Collegiate Athletic Association Division I American football players during a season. J. Strength Cond. Res. 27: 434-441.
Kris-Etherton, P. M., W. S. Harris, and L. J. Appel (2002). Fish consumption, fish oil, Omega-3 fatty acids, and cardiovascular disease. Circulation 106: 2747-2757.
Mall, N. A., J. Buchowski, L. Zebala, R. H. Brophy, R. W. Wright and, M. J. Matava (2012). Spine and axial skeleton injuries in the National Football League. Am. J. Sports Med. 40: 1755-1761.
Maroon, J. C., C. M. Mathyssek, J. W. Bost, A. Amos, R. Winkelman, A. P. Yates, M. A. Duca, and J. A. Norwig (2015). "Vitamin D profile in National Football League players. Am J Sports Med. E-pub ahead of print. PMID # 25649084.
Moberg, M., W. Apro, I. Ohlsson, M. Ponten, A. Villanueva, B. Ekblom, and E. Blomstrand (2014). Absence of leucine in an essential amino acid supplement reduces activation of mTORC1 signalling following resistance exercise in young females. Appl. Physiol. Nutr. Metab. 39: 183-194.
Moore, D. R., M. J. Robinson, J. L. Fry, J. E. Tang, E. I. Glover, S. B. Wilkinson, T. Prior, M. A. Tarnopolsky, and S. M. Phillips (2009). Ingested protein dose response of muscle and albumin protein synthesis after resistance exercise in young men. Am. J. Clin. Nutr. 89: 161-168.
Parr, E. B., D. M. Camera, J. L. Areta, L. M. Burke, S. M. Phillips, J. A. Hawley, and V. G. Coffey (2014). Alcohol ingestion impairs maximal post-exercise rates of myofibrillar protein synthesis following a single bout of concurrent training. PLoS One 9: e88384.
Pasiakos, S. M., L. M. Margolis, and J. S. Orr (2014). Optimized dietary strategies to protect skeletal muscle mass during periods of unavoidable energy deficit. Faseb J. E-pub ahead of print. PMID # 25550460.
Phillips, S. M., K. D. Tipton, A. Aarsland, S. E. Wolf, and R. R. Wolfe (1997). Mixed muscle protein synthesis and breakdown after resistance exercise in humans. Am. J. Physiol. 273: E99-E107.
Phillips, S. M., K. D. Tipton, A. A. Ferrando, and R. R. Wolfe (1999). Resistance training reduces the acute exercise-induced increase in muscle protein turnover. Am. J. Physiol. 276: E118-E124.
Res, P. T., B. Groen, B. Pennings, M. Beelen, G. A. Wallis, A. P. Gijsen, J. M. Senden, and L. van Loon (2012). Protein ingestion before sleep improves postexercise overnight recovery. Med. Sci. Sports Exerc 44: 1560-1569.
Ross, A. C., J. E. Manson, S. A. Abrams, J. F. Aloia, P. M. Brannon, S. K. Clinton, R. A. Durazo-Arvizu, J. C. Gallagher, R. L. Gallo, G. Jones, C. S. Kovacs, S. T. Mayne, C. J. Rosen, and S. A. Shapses (2011). The 2011 report on dietary reference intakes for calcium and vitamin D from the Institute of Medicine: what clinicians need to know. J. Clin. Endocrinol. Metab. 96: 53-58.
Schwalfenberg, G. K. (2011). A review of the critical role of vitamin D in the functioning of the immune system and the clinical implications of vitamin D deficiency. Mol. Nutr. Food Res. 55: 96-108.
Smith, G. I., P. Atherton, D. N. Reeds, B. S. Mohammed, D. Rankin, M. J. Rennie, and B. Mittendorfer (2011a). Dietary Omega-3 fatty acid supplementation increases the rate of muscle protein synthesis in older adults: a randomized controlled trial. Am. J. Clin. Nutr. 93: 402-412.
Smith, G. I., P. Atherton, D. N. Reeds, B. S. Mohammed, D. Rankin, M. J. Rennie, and B. Mittendorfer (2011b). Omega-3 polyunsaturated fatty acids augment the muscle protein anabolic response to hyperinsulinaemia-hyperaminoacidaemia in healthy young and middle-aged men and women. Clin. Sci. 121: 267-278.
Srikuea, R., X. Zhang, O. K. Park-Sarge, and K. A. Esser (2012). VDR and CYP27B1 are expressed in C2C12 cells and regenerating skeletal muscle: potential role in suppression of myoblast proliferation. Am. J. Physiol. 303: C396-C405.
Tartibian, B., B. H. Maleki, and A. Abbasi (2009). The effects of ingestion of Omega-3 fatty acids on perceived pain and external symptoms of delayed onset muscle soreness in untrained men. Clin. J. Sport Med. 19: 115-119.
Tipton, K. D., A. A. Ferrando, S. M. Phillips, D. Doyle, Jr., and R. R. Wolfe (1999). Postexercise net protein synthesis in human muscle from orally administered amino acids. Am. J. Physiol. 276:E628-E634.
White, J. H. (2008). Vitamin D signaling, infectious diseases, and regulation of innate immunity. Infect. Immun. 76: 3837-3843.
Zimmerman, J. L., and M. C. Shen (2013). Rhabdomyolysis. Chest 144: 1058-1065.