POINTS PRINCIPAUX
-
L’augmentation de la force et de la masse musculaire associée à l’entraînement peut être plus marquée si l’apport nutritionnel est optimisé.
-
L’entraînement de force et la prise d’un repas à haute teneur en acides aminés favorisent tous deux la synthèse des protéines.
-
Dans les deux cas, la synthèse des protéines est favorisée par l’intermédiaire d’une protéine kinase appelée cible mammalienne de la rapamycine (mTOR).
-
Les mécanismes par lesquels l’entraînement de force et l’ingestion (la consommation) d’acides aminés activent la mTOR diffèrent. Par conséquent, leurs effets sont additifs. Autrement dit, l’entraînement et l’ingestion d’acides aminés ont un effet plus important quand ils ont lieu en même temps plutôt que séparément.
-
L’augmentation rapide et prolongée (environ 1 heure) du taux sanguin de leucine, un acide aminé, favorise la synthèse des protéines qui, à leur tour, optimisent l’activation de la mTOR et l’augmentation de la synthèse des protéines musculaires et de la force musculaire.
-
Vous trouverez ci-dessous une stratégie nutritionnelle simple permettant de maximiser la réaction adaptative à l’entraînement de force.
INTRODUCTION
Depuis des millénaires, le principe fondamental selon lequel, pour augmenter la force musculaire, il faut soumettre les muscles à un effort intensif. Milon de Crotone est le premier à avoir mis ce principe en pratique. Milon était un fermier et un lutteur olympique. Au début de chacun de ces entraînements en vue des Olympiques, il choisissait un veau de son troupeau et il effectuait ses exercices matinaux en portant le veau sur les épaules. Plus le veau prenait du poids, plus la force de Milon augmentait. Pendant les Jeux olympiques, il serait entré dans le stade portant sur les épaules l’animal ayant atteint l’âge adulte, l’aurait jeté au sol et mangé. Cette légende nous rappelle que nos connaissances dans certains domaines ont peu évolué en 2 500 ans : pour augmenter la force musculaire, il est nécessaire d’effectuer des exercices contre résistance et de consommer des protéines de grande qualité.
Au cours des deux derniers millénaires, nous avons amélioré considérablement notre compréhension de la façon dont l’entraînement de force et l’alimentation permettent tous deux d’augmenter la masse musculaire et la force. Le présent article Sports Science Exchange fait état des connaissances actuelles à ce sujet, en plus de présenter des façons de mettre ce principe en pratique afin d’améliorer l’adaptation à l’entraînement.
RÉPONSE MOLÉCULAIRE À L’ENTRAÎNEMENT
Dans tous les modèles scientifiques de l’hypertrophie musculaire, tant chez la souris, le rat, le lapin, le poulet que chez l’humain, la première réponse à une séance d’entraînement de force est une augmentation de la synthèse des protéines. Si la synthèse des protéines s’effectue à un rythme qui dépasse celui de la dégradation musculaire, la masse et la force musculaires augmentent alors progressivement.
Au cours de la dernière décennie, les physiologistes s’intéressant à l’exercice d’un point de vue moléculaire ont montré que la cible mammalienne de la rapamycine (mTOR) est l’élément le plus important du mécanisme de régulation responsable de l’augmentation de la synthèse des protéines induite par l’entraînement. Si des humains prennent de la rapamycine, un immunosuppresseur qui bloque la mTOR, avant de prendre part à un entraînement de force, aucune augmentation de la synthèse des protéines n’est observée (Drummond et coll., 2009). Cette observation montre que la mTOR est nécessaire à l’augmentation de la synthèse des protéines musculaires après un exercice contre résistance. Une autre preuve de l’importance de mTOR est que la phosphorylation de la protéine S6K (un marqueur de l’activité de la mTOR) 30 minutes après un entraînement de force est le meilleur indicateur de l’augmentation de la masse musculaire et de la force de l’athlète (Figure 1; Terzis et coll., 2008). Même si la croissance musculaire ne dépend pas uniquement de l’activation de la mTOR, les entraîneurs et les athlètes devraient, autant que possible, tenter d’accroître l’activité de cette enzyme.
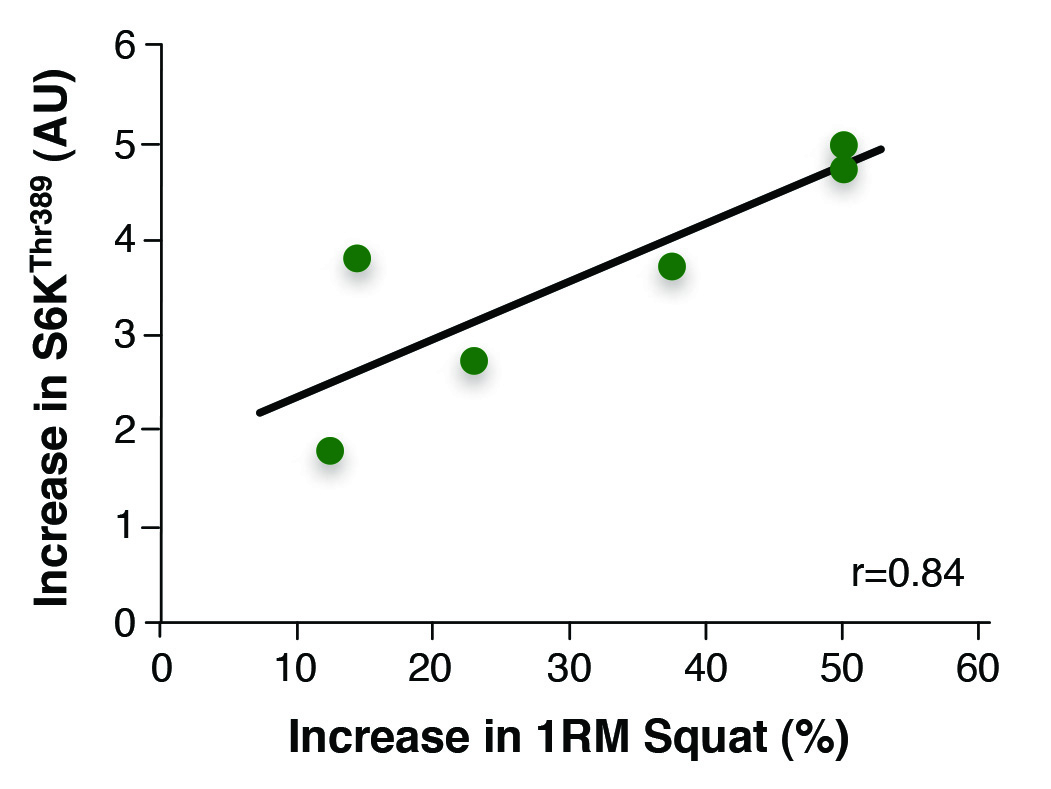
Figure 1. The relationship between the activity of mTOR and strength gains. The activity of mTOR (measured by determining Thr389 phosphorylation of S6K) 30 min after strength training is directly related to the increase in squat strength after 14 weeks of training. This suggests that mTOR activity plays a role in muscle growth. Adapted from (Terzis et al., 2008).
Si l’activation de la mTOR est une étape importante pour l’augmentation de la force, il est donc important de comprendre comment activer cette enzyme de façon maximale afin d’optimiser l’entraînement. À cette fin, il est essentiel de connaître de qui active et désactive la mTOR, ce qui devient de plus en plus clair grâce à de nombreuses études scientifiques de grande qualité.
Les spécialistes ont d’abord pensé que la seule façon d’activer la mTOR était de recourir aux facteurs de croissance, comme le facteur de croissance insulinomimétique 1 (IGF-1). Deux observations confirment cette hypothèse : 1) tant l’insuline que l’IGF-1 augmentent l’activité de la mTOR, ce qui augmente la synthèse des protéines (Coleman et coll., 1995) et 2) après un exercice contre résistance, une production plus élevée d’IGF-1 est observée dans les muscles (McKoy et coll., 1999). Les spécialistes avaient donc conclu que l’exercice contre résistance augmentait la production d’IGF-1 et, par conséquent, la synthèse des protéines. Nous savons maintenant que cette conclusion est inexacte et que la mTOR est activée directement par la charge mécanique exercée sur le muscle; l’IGF-1 ne joue qu’un rôle mineur dans l’augmentation de la masse musculaire induite par la charge mécanique (Philp et coll., 2011).
La charge mécanique exercée sur le muscle n’est toutefois pas le seul facteur qui active la mTOR. Même s’il est vrai que l’activation de la mTOR est proportionnelle au poids soulevé par une personne (Baar et Esser, 1999; Terzis et coll., 2010), nous savons maintenant que d’autres facteurs entrent en jeu. Quand un poids moins lourd est soulevé et que l’afflux sanguin au muscle est restreint (Fujita et coll., 2007) ou qu’un poids quelconque est soulevé jusqu’à l’échec (Mitchell et coll., 2012), la mTOR est alors activée, tout comme la synthèse des protéines. Par conséquent, les spécialistes sont maintenant d’avis que l’activité de la mTOR peut être augmentée de façon maximale par des exercices de force effectués jusqu’à l’échec. Dans le cadre d’un entraînement de force, l’échec est de deux types. L’échec est positif quand un athlète n’est plus en mesure de soulever un poids et l’échec est négatif quand l’entraîneur soulève un poids et le remet à l’athlète qui n’est pas en mesure d’en ralentir la chute.
ALIMENTATION POUR MAXIMISER L’ENTRAÎNEMENT
Soulever des poids lourds n’est toutefois pas suffisant pour accroître l’activité de la mTOR. Si un athlète s’entraîne à jeun, l’augmentation de l’activité de la mTOR et la synthèse des protéines ne sont pas optimales. Quand un athlète est à jeun, le bilan en protéines (la synthèse des protéines moins la dégradation des protéines) est négatif après l’entraînement (Figure 2). Afin d’activer la mTOR et la synthèse des protéines de façon optimale et ainsi obtenir un bilan en protéines positif dans le muscle, l’ingestion d’acides aminés est tout aussi nécessaire que l’activation mécanique.
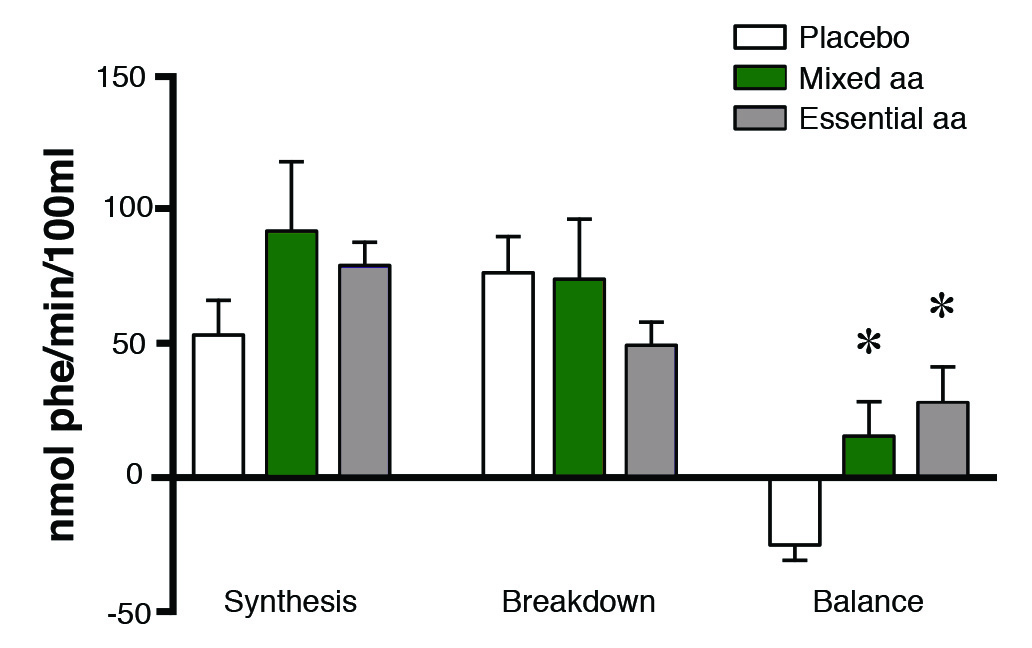
Figure 2. Essential amino acids are required for a positive protein balance. The effect of consuming a placebo or a drink containing all of the amino acids, or only the essential amino acids (aa) and arginine on protein synthesis, protein breakdown and net protein balance following resistance exercise in the fasted state. The y-axis is a measure of the rate of either protein synthesis or breakdown, and the resulting balance. Adapted from (Tipton et al., 1999).
Les acides aminés remplissent deux fonctions dans le muscle. D’abord, ils sont le composant de base essentiel à la synthèse de nouvelles protéines et, ensuite, ils agissent en tant que signal activant la mTOR.
Tous les acides aminés sont nécessaires à la synthèse des protéines, mais un seul d’entre eux est nécessaire à l’activation de la mTOR. Il s’agit de la leucine, un acide aminé à chaîne ramifiée. L’importance de la leucine s’explique par la présence, sur les cellules musculaires, d’un récepteur qui détecte les taux de leucine. Le récepteur de l’acide aminé active la mTOR par une série de protéines de transport appelées protéines Rag, qui assurent la liaison entre la mTOR et son activateur, la protéine Rheb. En pénétrant dans les cellules musculaires, la leucine active donc les protéines Rag qui, quant à elles, stimulent la liaison entre la mTOR et la protéine Rheb, ce qui a pour effet d’activer la mTOR et, par conséquent, d’accroître la synthèse des protéines ainsi que la masse et la force musculaires.
La leucine jouant un rôle important dans l’activation de la mTOR, il est important de comprendre comment, sur le plan nutritionnel, les différentes sources de protéines changent l’apport en leucine aux muscles. Les travaux de l’équipe de Stuart Phillips (Tang et coll., 2009) ont révélé que la concentration sanguine de leucine est plus élevée et que cette dernière reste élevée pendant plus longtemps chez un athlète qui consomme des protéines de lactosérum que chez un athlète qui consomme du soya ou de la caséine (Figure 3).
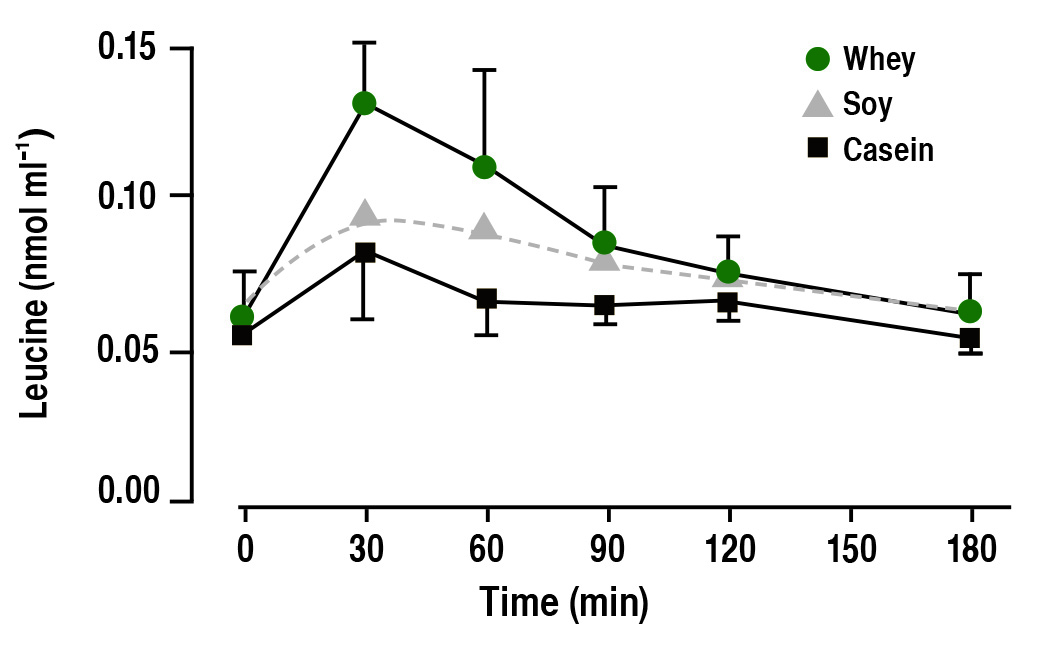
Figure 3. Leucine concentration in the blood after drinking an isonitrogenous amount of whey, soy or casein. Drinking a whey protein solution results in a faster, greater and more prolonged increase in the leucine concentration in the blood. Adapted from (Tang et al., 2009).
Par conséquent, à la lumière des données présentées ci-dessus, un taux plus élevé de leucine entraîne une augmentation significativement plus élevée de la synthèse des protéines musculaires, tant au repos qu’après un exercice contre résistance (Figure 4). Plus important encore, en suivant les athlètes pendant leur entraînement, les chercheurs ont pu montrer que l’augmentation de la masse musculaire est plus marquée chez les athlètes qui consomment des suppléments à base de protéines de lactosérum tout de suite après une séance d’entraînement (Tang et coll., 2009).
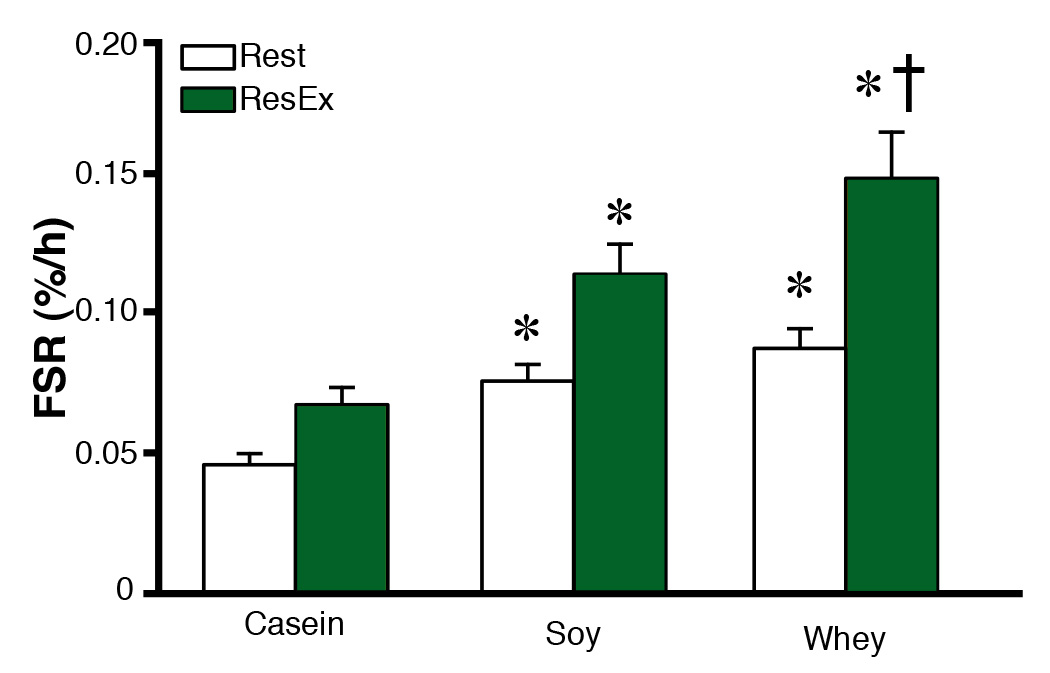
Figure 4. The effect of consuming a drink containing casein, soy or whey protein on protein synthesis (FSR, fractional synthetic rate) at rest and following resistance exercise. Adapted from (Tang et al., 2009).
La leucine ne peut pénétrer le muscle sans l’aide d’un transporteur. Dans le muscle squelettique, le principal transporteur de la leucine est le LAT-1 (L-type amino acid transporter 1), aussi connu sous le nom de SLC7A5. Il est nécessaire d’augmenter le nombre de transporteurs LAT-1 sur la membrane plasmatique pour augmenter l’activité de la mTOR et la synthèse des protéines. Les données actuelles laissent présager que tout de suite après un entraînement de force, le nombre de transporteurs LAT-1 augmente pendant une courte période (environ 90 minutes). Le nombre de molécules d’ARNm codant pour le LAT-1 demeure toutefois élevé pendant au moins 24 heures (Churchward-Venne et coll., 2012; Baar et coll., données non publiées). Grâce à ces observations, il est possible d’expliquer pourquoi 1) un apport en acides aminés tout de suite après un exercice contre résistance est la meilleure façon d’augmenter la synthèse des protéines musculaires (un plus grand nombre de transporteurs LAT-1 sur la membrane; Esmarck et coll., 2001); 2) l’effet des aliments à haute teneur en acides aminés sur la synthèse des protéines musculaires est plus important dans les 24 heures qui suivent une séance d’entraînement au cours de laquelle des poids lourds ont été soulevés (plus grand nombre de molécules d’ARNm pouvant produire un plus grand nombre de transporteurs LAT-1, ce qui augmente le captage de la leucine; Burd et coll., 2011).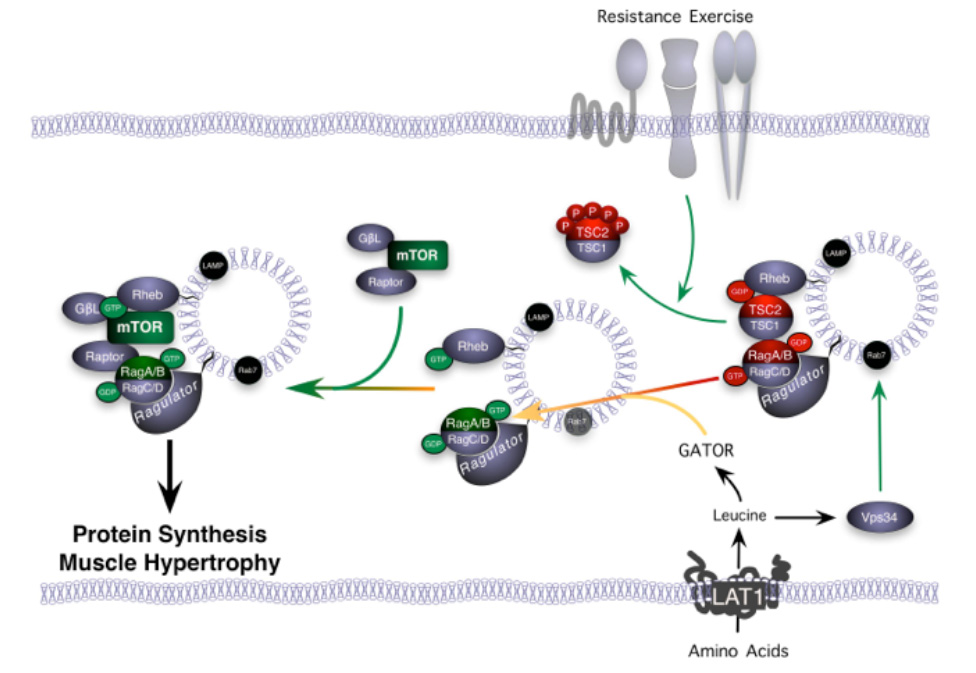
Figure 5. Schematic showing the activation of mTOR following resistance exercise. First, resistance exercise activates an unknown mechanoreceptor that phosphorylates and moves the mTOR inhibitor (tuberous sclerosis complex, TSC2) away from the mTOR activator (Rheb). Second, amino acids from the diet are taken up through transporters into the muscle. These amino acids activate the Rag family of small G-proteins. The Rag proteins physically grab mTOR, through its binding partner raptor, and move it to Rheb. Third, when mTOR is together with an active form of Rheb it is turned on and can activate protein synthesis. This is why when an athlete does resistance exercise followed by protein feeding there is more mTOR activity and protein synthesis.
RECOMMANDATIONS RELATIVES À L’ENTRAÎNEMENT, ÉTAYÉES PAR DES DONNÉES SCIENTIFIQUES, AFIN D’OPTIMISER L’ACTIVATION DE LA mTOR ET L’AUGMENTATION DE LA FORCE
En rassemblant toutes données présentées jusqu’à maintenant, un plan relativement simple peut être élaboré pour augmenter l’activité de la mTOR, la synthèse des protéines et la force musculaire (Figure 5).
-
Les athlètes devraient soulever des poids lourds jusqu’à l’échec afin d’augmenter la force musculaire de façon optimale. Ils peuvent y arriver en faisant une ou plus d’une série de chaque exercice. Si l’athlète fait une seule série d’exercices, il doit utiliser 100 % de la charge maximale qu’il peut soulever, un maximum de 8 fois jusqu’à l’échec (8 RM). Chaque série supplémentaire a peu d’effets sur l’augmentation cumulative de la force parce que chacune de ces séries est effectuée à un pourcentage de la 8 RM et l’exercice se fait donc jusqu’à l’échec uniquement au cours de la dernière série. C’est la raison pour laquelle l’augmentation de la force obtenue avec une seule série d’exercices est égale à celle obtenue avec plusieurs séries d’exercices (Mitchell et coll., 2012).
-
Tout de suite après un exercice contre résistance, l’athlète a besoin d’un apport en protéines rapidement assimilables et à haute teneur en leucine. Les produits laitiers (en particulier les protéines de lactosérum) et les œufs en sont des exemples. Faire augmenter rapidement la concentration sanguine de leucine permet de tirer parti d’un plus grand nombre de transporteurs LAT-1 sur les membranes après un exercice contre résistance.
-
Au cours des 24 heures suivant un exercice contre résistance, il faut prendre des repas contenant 20 g de protéines à haute teneur en leucine au lever et toutes les 3 à 4 heures pendant la journée. Chez les jeunes gens, une activation maximale de la synthèse des protéines est obtenue avec un apport de 20 g d’acides aminés (Moore et coll., 2009).
-
Il faut consommer de 30 à 40 g de protéines à haute teneur en leucine au coucher. Manger à l’heure du coucher améliore la synthèse des protéines pendant le sommeil tout en maintenant un bilan en protéine positif jusqu’au lever (Res et coll., 2012).
Le programme proposé ci-dessus peut maximiser la force musculaire. Le présent article porte sur mTOR, mais ce n’est que l’un des importants facteurs jouant un rôle dans l’augmentation de la force. La myostatine (un inhibiteur de croissance), le régulateur transcriptionnel Notch et le nombre de cellules satellites dans le muscle ont également un effet sur la masse musculaire. La façon dont ces facteurs agissent sur la taille et la force des muscles, ainsi que le rôle que pourrait avoir l’alimentation sur le mode d’action de ces facteurs restent à préciser.
RÉFÉRENCES
Baar K & Esser K. (1999). Phosphorylation of p70(S6k) correlates with increased skeletal muscle mass following resistance exercise. Am J Physiol 276, C120-127.
Burd NA, West DW, Moore DR, Atherton PJ, Staples AW, Prior T, Tang JE, Rennie MJ, Baker SK & Phillips SM. (2011). Enhanced amino acid sensitivity of myofibrillar protein synthesis persists for up to 24 h after resistance exercise in young men. The Journal of nutrition 141, 568-573.
Churchward-Venne TA, Burd NA, Mitchell CJ, West DW, Philp A, Marcotte GR, Baker SK, Baar K & Phillips SM. (2012). Supplementation of a suboptimal protein dose with leucine or essential amino acids: effects on myofibrillar protein synthesis at rest and following resistance exercise in men. The Journal of physiology.
Coleman ME, DeMayo F, Yin KC, Lee HM, Geske R, Montgomery C & Schwartz RJ. (1995). Myogenic vector expression of insulin-like growth factor I stimulates muscle cell differentiation and myofiber hypertrophy in transgenic mice. J Biol Chem 270, 12109-12116.
Drummond MJ, Fry CS, Glynn EL, Dreyer HC, Dhanani S, Timmerman KL, Volpi E & Rasmussen BB. (2009). Rapamycin administration in humans blocks the contraction-induced increase in skeletal muscle protein synthesis. J Physiol 587, 1535-1546.
Esmarck B, Andersen JL, Olsen S, Richter EA, Mizuno M & Kjaer M. (2001). Timing of postexercise protein intake is important for muscle hypertrophy with resistance training in elderly humans. J Physiol 535, 301-311.
Fujita S, Abe T, Drummond MJ, Cadenas JG, Dreyer HC, Sato Y, Volpi E & Rasmussen BB. (2007). Blood flow restriction during low-intensity resistance exercise increases S6K1 phosphorylation and muscle protein synthesis. J Appl Physiol (1985) 103, 903-910.
McKoy G, Ashley W, Mander J, Yang SY, Williams N, Russell B & Goldspink G. (1999). Expression of insulin growth factor-1 splice variants and structural genes in rabbit skeletal muscle induced by stretch and stimulation. J Physiol 516 ( Pt 2), 583-592.
Mitchell CJ, Churchward-Venne TA, West DW, Burd NA, Breen L, Baker SK & Phillips SM. (2012). Resistance exercise load does not determine training-mediated hypertrophic gains in young men. J Appl Physiol (1985) 113, 71-77.
Moore DR, Robinson MJ, Fry JL, Tang JE, Glover EI, Wilkinson SB, Prior T, Tarnopolsky MA & Phillips SM. (2009). Ingested protein dose response of muscle and albumin protein synthesis after resistance exercise in young men. The American journal of clinical nutrition 89, 161-168.
Philp A, Hamilton DL & Baar K. (2011). Signals mediating skeletal muscle remodeling by resistance exercise: PI3-kinase independent activation of mTORC1. J Appl Physiol (1985) 110, 561-568.
Res PT, Groen B, Pennings B, Beelen M, Wallis GA, Gijsen AP, Senden JM & van Loon LJ. (2012). Protein Ingestion Prior To Sleep Improves Post-Exercise Overnight Recovery. Medicine and science in sports and exercise.
Tang JE, Moore DR, Kujbida GW, Tarnopolsky MA & Phillips SM. (2009). Ingestion of whey hydrolysate, casein, or soy protein isolate: effects on mixed muscle protein synthesis at rest and following resistance exercise in young men. J Appl Physiol (1985) 107, 987-992.
Terzis G, Georgiadis G, Stratakos G, Vogiatzis I, Kavouras S, Manta P, Mascher H & Blomstrand E. (2008). Resistance exercise-induced increase in muscle mass correlates with p70S6 kinase phosphorylation in human subjects. Eur J Appl Physiol 102, 145-152.
Terzis G, Spengos K, Mascher H, Georgiadis G, Manta P & Blomstrand E. (2010). The degree of p70 S6k and S6 phosphorylation in human skeletal muscle in response to resistance exercise depends on the training volume. European journal of applied physiology 110, 835-843.
Tipton KD, Gurkin BE, Matin S & Wolfe RR. (1999). Nonessential amino acids are not necessary to stimulate net muscle protein synthesis in healthy volunteers. J Nutr Biochem 10, 89-95.